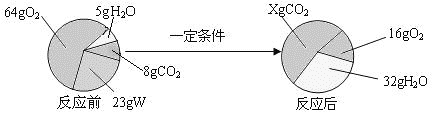
题目内容
【题目】小明用蜡烛进行了下列实验。
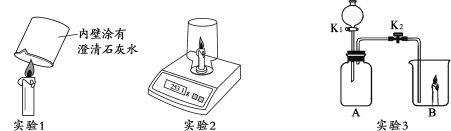
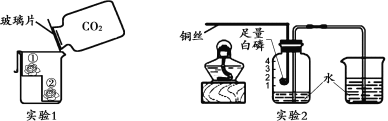
(1)实验1中,烧杯内发生反应的化学方程式为____________。
(2)实验2中,电子秤的示数______(填“变大”“变小”或“不变”) 。
(3)实验3中,若B中蜡烛燃烧更旺,A中盛放的固体和液体药品是__________;若B中蜡烛熄灭,则A中反应的化学方程式为_________,蜡烛熄灭的原因是________。
【答案】CO2+Ca(OH)2 === CaCO3↓+H2O 不变 二氧化锰和过氧化氢 CaCO3+2HCl === CaCl2+H2O+CO2↑ 反应生成二氧化碳使蜡烛隔绝了氧气
【解析】
(1)实验1中,烧杯内发生反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为CO2+Ca(OH)2 === CaCO3↓+H2O;
(2)据质量守恒定律可知,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以反应前后物质的总质量不变,实验2中,电子秤的示数不变;
(3)实验3中,若B中蜡烛燃烧更旺,说明通入B的是氧气,A中盛放的固体和液体药品是二氧化锰和过氧化氢溶液,过氧化氢在二氧化锰的作用下分解生成氧气助燃,使蜡烛燃烧更旺;若B中蜡烛熄灭,则通入B的是二氧化碳,二氧化碳不可燃、不助燃能使燃着的蜡烛熄灭,A中反应是碳酸钙和稀盐酸反应生成二氧化碳、氯化钙、水,化学方程式为CaCO3+2HCl === CaCl2+H2O+CO2↑,燃烧需要可燃物与氧气充分接触,蜡烛熄灭的原因是反应生成二氧化碳使蜡烛隔绝了氧气。

练习册系列答案
相关题目