题目内容
【题目】学习碱的个性时,同学们在实验室中做“检测氢氧化钙性质 ”的实验,实验方案如图所示(说明:实验中使用的药品均是溶液)。
请回答下列问题:
(1)写出盐酸加入氢氧化钙中反应的化学方程式: ;在实验过程中 ,并没有观察到该反应的明显现象 ,请你写出一种能观察到变化发生的方法: 。
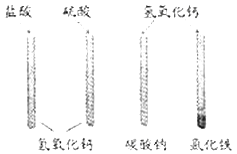
(2)实验结束后,同学们将四支试管中的物质全部倒入废液缸中,为了处理废液渣,首先对废液缸中物质的成分进行初步分析,过程如下图所示:
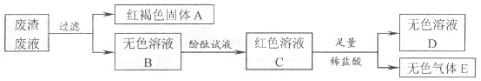
由上述分析可知:
①固体A中一定还有碳酸钙和 。
②无色溶液 B中使酚酞试液变红的物质是 。
【答案】(1)Ca(OH)2+2HCl=CaCl2+2H20;先往氢氧化钙中滴1~2滴无色酚酞试液(或紫色石蕊试液);(2)①氢氧化铁或Fe(OH)3;②一定有碳酸钠,可能有氢氧化钠;
【解析】题主要考查酸和碱反应以及与指示剂的反应的现象、溶液的酸碱度、碱的化学性质、中和反应的应用,难度较大。(1)盐酸与氢氧化钙反应生成氯化钙和水,反应的化学方程式为:)Ca(OH)2+2HCl=CaCl2+2H20;借助中和反应发生时溶液的pH的变化情况,在碱的溶液中滴加酚酞,溶液变红加酸能使红色消失,则说明酸与碱能够发生反应;(2)①因为氢氧化钙与碳酸钠反应生成碳酸钙白色沉淀和氢氧化钙与氯化铁反应生成红褐色的氢氧化铁沉淀,故固体A中一定含有碳酸钙和氢氧化铁;②根据红色溶液加稀盐酸生成无色气体,故溶液中一定有碳酸钠,碳酸钠有剩余,说明氢氧化钙完全反应,生成氢氧化钠,如果氯化铁不足量,则会有氢氧化钠剩余,故无色溶液B中使酚酞试液变红的物质一定有碳酸钠,可能有氢氧化钠。

 阅读快车系列答案
阅读快车系列答案【题目】某同学测定了一些食物的pH如下.根据表中数据判断有关说法正确的是( )
食物 | 蕃茄 | 橘子 | 鸡蛋清 | 牛奶 | 玉米 |
pH | 4 | 3 | 8 | 6 | 8 |
A.胃酸过多的病人适宜多吃橘子
B.牛奶和鸡蛋清都显碱性
C.番茄的酸性比橘子强
D.橘子汁能使紫色石蕊试液变红