题目内容
【题目】化学是一门研究物质的组成、结构、性质以及变化规律的自然科学,用初中化学的相关知识完成下列填空:
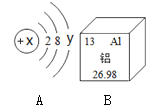
①空气是由多种气体组成的混合物,其中体积分数最大的物质是____,属于氧化物是___(写出一种即可),能供给动物呼吸的气体是____。(本小题用化学式表示)
②高锰酸钾固体在加热条件下发生化学变化:2KMnO4![]() K2MnO4+MnO2+[ ]↑ “[ ]”中应填入的物质是____。
K2MnO4+MnO2+[ ]↑ “[ ]”中应填入的物质是____。
③我国著名科学家侯德榜发明了“联合制碱法”,对纯碱制取工业做出巨大贡献。在“联合制碱法中”有一种生成物是氯化铵(NH4Cl),该物质由____种元素组成。氯化铵是一种化肥,属于____肥(填元素名称)。请你写出氯化铵中所含原子团的名称____。氯化铵中氮元素的质量分数是_____(写出计算过程,不需计算结果)。
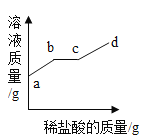
④波尔多液具有一定的杀菌效果,可以防治某些植物病害。通常用1%的硫酸铜溶液与熟石灰混合制得。若要配置1000克1%的硫酸铜溶液,需要5%的硫酸铜溶液的质量是____克。
【答案】N2 CO2 O2 O2 三 氮 铵根 ![]() (答案合理即可) 200
(答案合理即可) 200
【解析】
①空气的成分按体积分数计算大约是:大约是氮气占(78%),氧气占(21%),稀有气体占(0.94%),二氧化碳占(0.03%),其它气体和杂质占(0.03%),所以含量最大的气体是氮气,属于氧化物是二氧化碳;氧气以供给呼吸.故答案为:N2;CO2; O2;
②化学反应前后各原子的种类和数目不变,所以右侧还少2个氧,所以是氧气;
③由化学式:NH4Cl可知该物质由三种元素组成;其中含有氮元素,属于氮肥;氯化铵中原子团是铵根;氮元素质量分数=![]() ×100%
×100%
④设需要5%的硫酸铜溶液的质量是X则:1000×1%=X×5%,解得X=200g
(故答案为:①N2;CO2;O2;②O2;③三;氮;铵根;![]() ×100%
×100%
(答案合理即可)④200.

【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
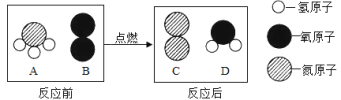
【进行实验】选择如下图所示装置进行验证:
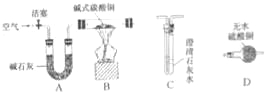
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式 ;
②写出Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。