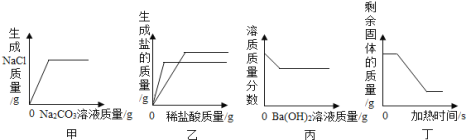
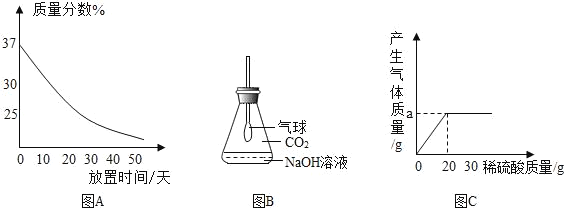
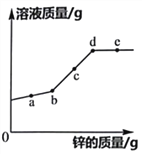
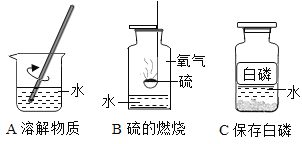
题目内容
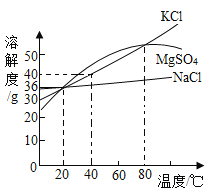
【题目】如图是A、B两种物质的溶解度曲线,根据图示回答下列问题:
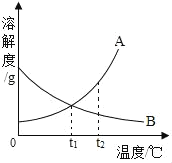
(1)t1℃时,A、B两种物质的溶解度是A_____B(填“>”、“<”或“=”,下同)。
(2)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A_____B。
(3)t1℃时,100g水中溶解50gA刚好饱和,那么50g水中溶解_____ gB也刚好达饱和。
【答案】= > 25
【解析】
A、B两种物质的溶解度曲线可知,A物质的溶解度随温度的升高而增大,B物质的溶解度随温度的升高而减小。
(1)t1℃时,A、B两种物质的溶解度是A等于B,因为该温度下,它们有交点;故溶解度是A=B。
(2)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A>B,因为降温B没有固体析出。
(3)t1℃时,100g水中溶解50gA刚好饱和,那么50g水中溶解25gB也刚好达饱和。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:
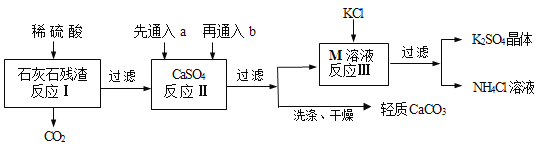
已知:CaCO3+H2O+CO2=Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____________(填序号);
①搅拌
②将残渣粉碎成细小颗粒
③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是_______________(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为___________,反应Ⅲ在常温下能实现的原因是________,生成的NH4Cl溶液在农业上可用作_______________;
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,______(①滴加稀盐酸、② 滴加Na2SO4 溶液、③ 滴加BaCl2溶液,填写序号),若无明显的现象,则已洗净;
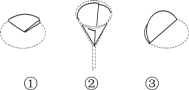
(5)过滤器的制作如图,正确的顺序是______(填序号);
(6)该工艺流程中循环利用的物质除了水,还有_________________________。