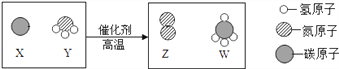
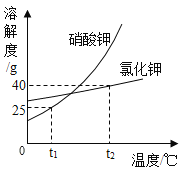
��Ŀ����
����Ŀ��ʵ��������һƿ��ɫ��ҺA,��֪���е����ʿ�����NaOH��BaCl2������֮һ������һ��������B,���п��ܺ���NH4Cl��(NH4)2SO4��CuCl2��FeCl3���������е����ֻ���֡�ijѧϰС���ͬѧ��̽����ɫ��ҺA��������B�ijɷ�,��Ʋ�����ͼ��ʾ����̽��ʵ��,���ֵ�������ͼ������(����������з����ķ�Ӧ��ǡ����ȫ��Ӧ)��
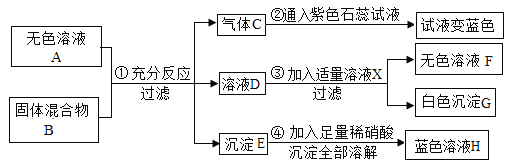
�Ը���ʵ����̺ͷ��������������ж�,��д���¿հ�:
(1)��������ɵ�����C��_________(�ѧʽ)��
(2)д������ܷ�Ӧ�Ļ�ѧ����ʽ_______________________________________��
(3)����ҺXΪϡ����,��ɫ����G��_____(�ѧʽ)����ɫ��ҺA�������������ڵĽ�����������_______(�����ӷ���),��������B��һ�������ڵ�������______(�ѧʽ)��
(4)����ҺXΪBa(NO3)2��Һ,��������B�в���ȷ���Ƿ���ڵ�������_____(�ѧʽ)��
���𰸡�NH3 ![]() BaSO4 Na+��Ba2+ (NH4)2SO4��FeCl3 NH4Cl
BaSO4 Na+��Ba2+ (NH4)2SO4��FeCl3 NH4Cl
��������
�̬���ʺͼӦ�����ɰ�����������ʹ��ɫʯ����Һ����ɫ�����������Ӻ�ͭ���ӻ�����������ͭ������������ͭ���ᷴӦ��������ɫ��Һ�����������Ӻ������ӷ�Ӧ�������������������������������ᷴӦ�����ɻ�ɫ��Һ�����Գ���E�м������ᣬ������ȫ�ܽ⣬������ɫ��Һ�����Գ���E��������ͭ��H������ͭ��A��һ�������������ƣ�B�к����Ȼ�ͭ������C��ʹ��ɫʯ����Һ����ɫ������C�ǰ�����B�к����Ȼ�李�������е�һ�ֻ����֣�����
��1�����������ɵ�����C��NH3��
��2���������ķ�Ӧ��������ͭ�����ᷴӦ��������ͭ��ˮ����ѧ����ʽΪ��![]() ��
��
��3������ҺXΪϡ���ᣬ��������Ӻͱ����ӷ�Ӧ�������ᱵ����������ɫ����G��BaSO4����ɫ��ҺA�Щ����������ڵĽ����������� Na+��Ba2+������������Ӻͱ����Ӳ��ܹ��棬���Թ�������B��һ�������ڵ������ǣ�(NH4)2SO4��FeCl3�������FeCl3������E�о��������������ټ��������ͻ���ֻ�ɫ��Һ������Ŀì�ܣ���
��4������ҺXΪBa(NO3)2��Һ����������ɰ�ɫ����G����Ba(NO3)2��Һ��A�п��ܺ���NaOH��BaCl2�ĸ�������Ӧ���ʿ�ȷ��B�к�������泥���ɫ��ҺH��������ȷ������CuCl2û��FeCl3�����Թ�������B�в���ȷ���Ƿ���ڵ�������NH4Cl��
�ʴ�Ϊ
��1��NH3��
��2��![]() ��
��
��3��BaSO4��Na+��Ba2+��(NH4)2SO4��FeCl3��
��4��NH4Cl��