题目内容
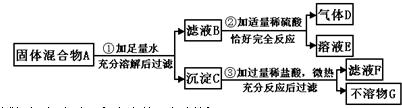
实验室中现有一种固体混合物,其中可能含有Fe2O3、Fe(OH)3、CaCO3、Na2CO3、BaCl2五种物质中的两种或多种.按下图所示进行实验((设过程中所有可能发生的反应均恰好完全反应)
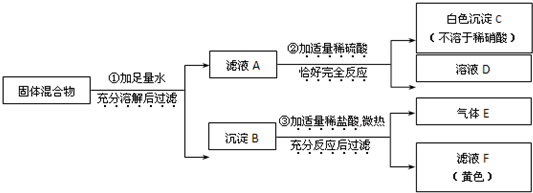
试根据实验过程和发生的现象判断:
(1)白色沉淀C是
(2)原固体混合物中,一定存在的物质是(写化学式)
(3)滤液F中,一定存在的阳离子是
(4)写出过程②中发生的化学反应中的化学方程式
(5)写出过程③中可能发生的化学反应中的一个化学方程式(只能写1个,多写该空不得分):

试根据实验过程和发生的现象判断:
(1)白色沉淀C是
BaSO4
BaSO4
,产生的气体E是CO2
CO2
.(写化学式)(2)原固体混合物中,一定存在的物质是(写化学式)
CaCO3、BaCl2
CaCO3、BaCl2
.(3)滤液F中,一定存在的阳离子是
Fe3+
Fe3+
.(4)写出过程②中发生的化学反应中的化学方程式
BaCl2+H2SO4=BaSO4↓+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
.(5)写出过程③中可能发生的化学反应中的一个化学方程式(只能写1个,多写该空不得分):
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.分析:本题属于推断题,根据题目给出的流程图和信息:Fe2O3、Fe(OH)3、CaCO3都不溶于水,Na2CO3、BaCl2不能共存,滤液A中加入适量的硫酸生成不溶于稀硝酸的白色沉淀,因此A中一定有氯化钡,那么一定没有碳酸钠;沉淀B中加入稀盐酸有气体E放出,说明沉淀中一定有碳酸钙,滤液F是黄色,因此滤液F中一定有铁离子,那么固体中有氧化铁或氢氧化铁或氧化铁和氢氧化铁的混合物.氯化钡与硫酸反应生成硫酸钡白色沉淀和盐酸,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可.
解答:解:(1)氯化钡与硫酸反应生成硫酸钡白色沉淀和盐酸,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,因此白色沉淀C是硫酸钡,气体E是二氧化碳,故答案为:BaSO4;CO2
(2)滤液A中加入适量的硫酸生成不溶于稀硝酸的白色沉淀,因此A中一定有氯化钡,那么一定没有碳酸钠;沉淀B中加入稀盐酸有气体E放出,说明沉淀中一定有碳酸钙,滤液F是黄色,因此滤液F中一定有铁离子,那么固体中有氧化铁或氢氧化铁或氧化铁和氢氧化铁的混合物.故答案为:Fe2O3或Fe(OH)3(或Fe2O3和Fe(OH)3)、CaCO3、BaCl2
(3)通过我们学过的知识可知,有铁离子的溶液呈黄色,因为滤液F是黄色,因此滤液F中一定有铁离子,故答案为:Fe3+
(4)氯化钡与硫酸反应生成硫酸钡白色沉淀和盐酸,配平即可,故答案为:BaCl2+H2SO4=BaSO4↓+2HCl
(5)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可.故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑(合理即可)
(2)滤液A中加入适量的硫酸生成不溶于稀硝酸的白色沉淀,因此A中一定有氯化钡,那么一定没有碳酸钠;沉淀B中加入稀盐酸有气体E放出,说明沉淀中一定有碳酸钙,滤液F是黄色,因此滤液F中一定有铁离子,那么固体中有氧化铁或氢氧化铁或氧化铁和氢氧化铁的混合物.故答案为:Fe2O3或Fe(OH)3(或Fe2O3和Fe(OH)3)、CaCO3、BaCl2
(3)通过我们学过的知识可知,有铁离子的溶液呈黄色,因为滤液F是黄色,因此滤液F中一定有铁离子,故答案为:Fe3+
(4)氯化钡与硫酸反应生成硫酸钡白色沉淀和盐酸,配平即可,故答案为:BaCl2+H2SO4=BaSO4↓+2HCl
(5)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可.故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑(合理即可)
点评:本考点属于图框式物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题;本题属于第一种类型.不论哪一种类型,都是通过实验现象,从而得出物质的组成.此考点主要出现在填空题和实验题中.

练习册系列答案
相关题目