题目内容
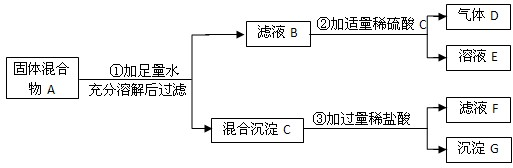
实验室中现有一种固体混合物,其中可能含有CuO、AgCl、Na2CO3、Na2SO4、Ba(NO3)2 四种物质中的两种或多种.按图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应均恰好完全反应).

试根据实验过程和发生的现象填写下列空白:
(1)气体D的化学式为
(3)蓝色溶液F中一定存在的阳离子是
(3)写出过程②中发生的化学反应方程式
(4)不能确定有无的物质是

试根据实验过程和发生的现象填写下列空白:
(1)气体D的化学式为
CO2
CO2
.(3)蓝色溶液F中一定存在的阳离子是
Cu2+
Cu2+
、H+
H+
.(写离子符号)(3)写出过程②中发生的化学反应方程式
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
.(4)不能确定有无的物质是
Na2SO4
Na2SO4
,若要确定它是否存在,请设计实验方案(包括操作步骤、现象、结论)在蓝色溶液F中滴加氯化钡溶液,如果能生成沉淀,则可证明固体中存在硫酸钠,否则没有硫酸钠
在蓝色溶液F中滴加氯化钡溶液,如果能生成沉淀,则可证明固体中存在硫酸钠,否则没有硫酸钠
.分析:固体混合物加入水后得到沉淀C,向C中加入稀盐酸后生成蓝色溶液,说明在沉淀中有氧化铜,但是仍有沉淀G,从所给的物质可以判断出该沉淀应该为氯化银;对于滤液B加入稀硫酸后生成了气体,说明存在着碳酸钠,同时可以排除硝酸钡的存在,可以据此答题.
解答:解:(1)向滤液B中加入稀硫酸产生了气体D,分析所给的物质,能与酸反应产生气体的物质是碳酸盐,所以产生的气体是CO2;
(2)向C中加入稀盐酸后生成蓝色溶液,说明在沉淀中有氧化铜,蓝色是由于氯化铜溶液体现的,另外由于盐酸过量,所以滤液F的溶质是氯化铜和氯化氢.故阳离子为Cu2+和H+;
(3)由以上的分析可知反应②是碳酸钠与稀硫酸的反应,其方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(4)最后还有不溶物存在,说明有不与稀盐酸反应的物质,分析所给的几种物质,氯化银不与稀盐酸反应,所以一定含氯化银,根据(1)的分析可知一定含碳酸钠,由于碳酸钠和硝酸钡能够生成碳酸钡的沉淀,所以一定不含硝酸钡,因此混合物A中含有的物质是:Na2CO3、AgCl、CuO,可能含有硫酸钠;
(5)如果要判断混合物中是否含有硫酸钠,可以在蓝色溶液F中滴加氯化钡溶液,如果能生成沉淀,则可证明固体中存在硫酸钠;
故答案为:(1)CO2;(2)Cu2+;H+;(3)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;(4)Na2SO4;在蓝色溶液F中滴加氯化钡溶液,如果能生成沉淀,则可证明固体中存在硫酸钠,否则没有硫酸钠;
(2)向C中加入稀盐酸后生成蓝色溶液,说明在沉淀中有氧化铜,蓝色是由于氯化铜溶液体现的,另外由于盐酸过量,所以滤液F的溶质是氯化铜和氯化氢.故阳离子为Cu2+和H+;
(3)由以上的分析可知反应②是碳酸钠与稀硫酸的反应,其方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(4)最后还有不溶物存在,说明有不与稀盐酸反应的物质,分析所给的几种物质,氯化银不与稀盐酸反应,所以一定含氯化银,根据(1)的分析可知一定含碳酸钠,由于碳酸钠和硝酸钡能够生成碳酸钡的沉淀,所以一定不含硝酸钡,因此混合物A中含有的物质是:Na2CO3、AgCl、CuO,可能含有硫酸钠;
(5)如果要判断混合物中是否含有硫酸钠,可以在蓝色溶液F中滴加氯化钡溶液,如果能生成沉淀,则可证明固体中存在硫酸钠;
故答案为:(1)CO2;(2)Cu2+;H+;(3)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;(4)Na2SO4;在蓝色溶液F中滴加氯化钡溶液,如果能生成沉淀,则可证明固体中存在硫酸钠,否则没有硫酸钠;
点评:解决此类框图式物质推断题时,要根据酸碱盐物质间的复分解反应,结合各物质间反应的实验现象,对此题做出合理的判断,所以要求同学们在平时的学习中要加强知识的储备.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目