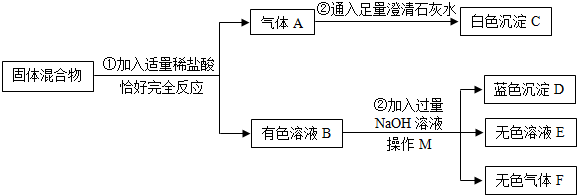
题目内容
(2013?历城区一模)在已调平衡的托盘天平两边各放一只等质量的烧杯,在两只烧杯里分别注入200g溶质质量分数为7.3%的稀盐酸,调至天平平衡后,向左边烧杯中加入2.8gFe,要使充分反应后天平仍然保持平衡,需向右边烧杯中加入金属铜的质量为( )
分析:因为加入的盐酸质量相等,所以需要判断两端加入一定量物质后增加质量是否相等,增加质量相等时天平能仍然保持平衡,不相等时天平发生偏转.可根据化学方程式,借助关系式进行分析计算.
解答:解:首先要分析所加的Fe是否完全反应,并设天平左边烧杯内加入金属Fe后产生氢气的质量为x,
Fe+2HCl=FeCl2+H2↑
56 73 2
2.8g 200g×7.3% x
根据方程式及各物质的量可知Fe完全反应,盐酸过量,故有
=
,解得:x=0.1g; 即加入Fe的烧杯质量增加2.8g-0.1g=2.7g;由于铜和盐酸不反应,所以要使天平平衡右边烧杯也应增加2.7g,则要加铜的质量是2.7g;
故选A.
Fe+2HCl=FeCl2+H2↑
56 73 2
2.8g 200g×7.3% x
根据方程式及各物质的量可知Fe完全反应,盐酸过量,故有
| 56 |
| 2.8g |
| 2 |
| x |
故选A.
点评:加入物质充分反应后生成气体,天平一端增加的质量=加入固体质量-放出气体的质量,只有两边增重质量相等时,天平才能保持平衡,此题要在掌握化学方程式的计算的基础上灵活分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2013?历城区一模)A、B两种物质的溶解度曲线如图所示.t3℃时,将A、B分别溶于100g水中,各自配成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法中不正确的是( )
(2013?历城区一模)A、B两种物质的溶解度曲线如图所示.t3℃时,将A、B分别溶于100g水中,各自配成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法中不正确的是( )