题目内容
(2013?历城区一模)有一包固体混合物粉末,已知其中可能是(NH4)2CO3、Na2SO4、Fe2O3、CuO中的一种或几种.某研究小组为探究其成分,按如图所示进行实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全反应).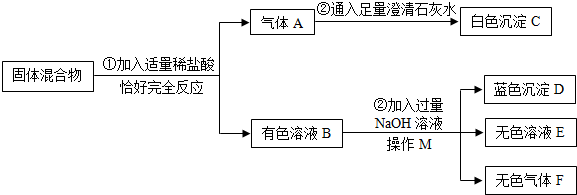
根据以上信息,回答下列问题:
(1)操作M的名称为
(2)无色溶液E中一定含有的溶质的化学式是
(3)写出过程③中产生蓝色沉淀的化学方程式为
(4)原固体混合物中一定含有的物质是
①取一定量的原固体混合物放入一只盛有足量水的烧杯中,搅拌,充分溶解后,过滤,得到滤液G.
②向滤液G中加入过量的稀硝酸,充分反应后得到溶液H.
③再向溶液H中滴加无色溶液I,产生现象X.
若现象X为

根据以上信息,回答下列问题:
(1)操作M的名称为
过滤
过滤
,无色气体F的化学式为NH3
NH3
.(2)无色溶液E中一定含有的溶质的化学式是
NaCl
NaCl
.(3)写出过程③中产生蓝色沉淀的化学方程式为
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
.(4)原固体混合物中一定含有的物质是
(NH4)2CO3、CuO
(NH4)2CO3、CuO
,可能含有的物质是Na2SO4
Na2SO4
.为了进一步验证不确定的物质是否存在,设计了如下实验方案:①取一定量的原固体混合物放入一只盛有足量水的烧杯中,搅拌,充分溶解后,过滤,得到滤液G.
②向滤液G中加入过量的稀硝酸,充分反应后得到溶液H.
③再向溶液H中滴加无色溶液I,产生现象X.
若现象X为
产生白色沉淀
产生白色沉淀
,则该物质一定存在.分析:由反应的情况可知该物质加酸可以生成二氧化碳,则该物质中一定含有碳酸盐,加入碱液能生成蓝色沉淀氢氧化铜,所以该物质中一定含有氧化铜,而无红褐色沉淀氢氧化铁生成,则该物质中一定不会含有氧化铁,有无色气体生成,说明一定含有铵根离子,而后依据硫酸根离子常用硝酸酸化的钡离子进行检验即可解答本题;
解答:解:由反应的情况可知该物质加酸可以生成二氧化碳,则该物质中一定含有碳酸盐,加入碱液能生成蓝色沉淀氢氧化铜,所以该物质中一定含有氧化铜,而无红褐色沉淀氢氧化铁生成,则该物质中一定不会含有氧化铁,有无色气体生成,说明一定含有铵根离子,则该物质中一定含有(NH4)2CO3、CuO,一定不含氧化铁,可能含有硫酸钠;
(1)由于操作M是完成的固体和液体的分离过程,故M为过滤操作;无色气体F是氯化铵与氢氧化钠反应生成的氨气,化学式为NH3;
(2)无色溶液E是在生成蓝色氢氧化铜沉淀后的溶液,氯化铵、氯化铜与氢氧化钠反应后均生成氯化钠,溶液中一定含有此溶质;
(3)过程③中产生蓝色沉淀的化学反应是氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,方程式是:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)由以上分析知原混合物中一定含有氧化铜、碳酸铵,可能含有硫酸钠;
由以上推断可知该物质中是否含有硫酸钠无法确定,所以①将原固体混合物加入盛有足量水的烧杯中,充分溶解后,过滤,是除掉氧化铜;
②向滤液G中加入过量的稀硝酸,充分反应后得到溶液H,是硝酸的酸化过程,除掉碳酸铵;
③再向溶液H中滴加无色溶液I为钡盐的溶液,如果能够生成硫酸钡的白色沉淀,则可证明含有硫酸钠;
故答案为:(1)过滤;NH3;
(2)2NaCl;
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)(NH4)2CO3、CuO;Na2SO4;产生白色沉淀.
(1)由于操作M是完成的固体和液体的分离过程,故M为过滤操作;无色气体F是氯化铵与氢氧化钠反应生成的氨气,化学式为NH3;
(2)无色溶液E是在生成蓝色氢氧化铜沉淀后的溶液,氯化铵、氯化铜与氢氧化钠反应后均生成氯化钠,溶液中一定含有此溶质;
(3)过程③中产生蓝色沉淀的化学反应是氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,方程式是:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)由以上分析知原混合物中一定含有氧化铜、碳酸铵,可能含有硫酸钠;
由以上推断可知该物质中是否含有硫酸钠无法确定,所以①将原固体混合物加入盛有足量水的烧杯中,充分溶解后,过滤,是除掉氧化铜;
②向滤液G中加入过量的稀硝酸,充分反应后得到溶液H,是硝酸的酸化过程,除掉碳酸铵;
③再向溶液H中滴加无色溶液I为钡盐的溶液,如果能够生成硫酸钡的白色沉淀,则可证明含有硫酸钠;
故答案为:(1)过滤;NH3;
(2)2NaCl;
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)(NH4)2CO3、CuO;Na2SO4;产生白色沉淀.
点评:此题为框图式物质推断题,解答时关键是找准解题突破口,分析清楚反应流程,得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.

练习册系列答案
相关题目
 (2013?历城区一模)A、B两种物质的溶解度曲线如图所示.t3℃时,将A、B分别溶于100g水中,各自配成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法中不正确的是( )
(2013?历城区一模)A、B两种物质的溶解度曲线如图所示.t3℃时,将A、B分别溶于100g水中,各自配成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法中不正确的是( )