题目内容
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
(查阅资料)
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液没有气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和NH3.
(问题探究)
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式_____.
(2)工业级NaN3中常含有少量的Na2CO3,其原因是_____(用化学方程式表示).
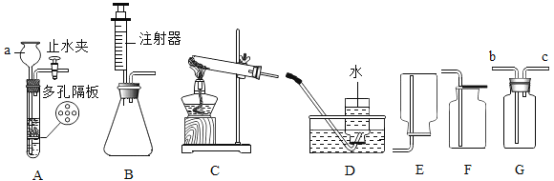
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,小组同学设计了如图实验装置.
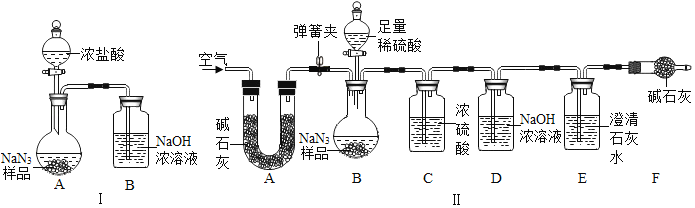
①小明同学认为通过测定装置Ⅰ中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组同学通过讨论装置Ⅰ认为很多因素会导致测定数据不准确,误差太大.小明同学在大家讨论的基础上,又设计了装置Ⅱ.请装置Ⅱ中A的作用是_____;若无装置C,对测定结果造成的影响是_____(填“偏大”、“偏小”或“无影响”);装置E的作用是_____.
②根据装置Ⅱ,小组同学设计的实验步骤有:
a.称量装置
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
为保证测定结果精确,正确的操作顺序为_____(填字母序号,可重复).
③计算碳酸钠的质量分数时,至少需要测定_____个数据.(填数字)
【答案】2NaN3![]() 2Na+3N2↑ 2NaOH+CO2═Na2CO3+H2O 除去空气中的二氧化碳 偏大 检验二氧化碳是否被D装置完全吸收 bcadca 3
2Na+3N2↑ 2NaOH+CO2═Na2CO3+H2O 除去空气中的二氧化碳 偏大 检验二氧化碳是否被D装置完全吸收 bcadca 3
【解析】
解:(1)汽车经撞击后,NaN3迅速分解生成钠和氮气,该反应的化学方程式为:2NaN3![]() 2Na+3N2↑.
2Na+3N2↑.
故填:2NaN3![]() 2Na+3N2↑.
2Na+3N2↑.
(2)工业级NaN3中常含有少量的Na2CO3,其原因是氢氧化钠和空气中的二氧化碳反应生成了碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故填:2NaOH+CO2═Na2CO3+H2O.
(3)①装置Ⅱ中A的作用是除去空气中的二氧化碳;
若无装置C,水蒸气会进入D装置中,导致测定的二氧化碳质量偏大,从而导致测定结果偏大;
装置E的作用是检验二氧化碳是否被D装置完全吸收.
故填:除去空气中的二氧化碳;偏大;检验二氧化碳是否被D装置完全吸收.
②为保证测定结果精确,正确的操作顺序为:称量样品,检查装置气密性,打开弹簧夹,鼓入空气,称量装置D,关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞,打开弹簧夹,鼓入空气,称量装置D.
故填:bcadca.
③计算碳酸钠的质量分数时,至少需要测定样品质量,反应前D装置的质量,反应后D装置的质量等3个数据.
故填:3.