题目内容
【题目】实验室常用的制取气体的装置如图:
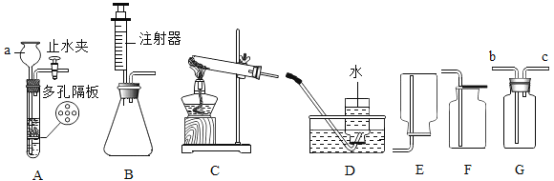
(1)仪器a的名称_____。
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气,化学方程式为________,选用的装置组合可以是_____。若用C装置制取氧气,写出反应的化学方程式_____。用制得的氧气做铁丝燃烧实验时没看见火星四射,原因可能是_____。
【答案】长颈漏斗 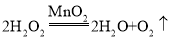 BD或BE
BD或BE 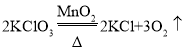 铁丝表面的铁锈未除去或氧气不纯等
铁丝表面的铁锈未除去或氧气不纯等
【解析】
过氧化氢溶液和二氧化锰混合制取氧气选择固液不加热型装置,收集氧气用排水法或者向上排空气法;加热氯酸钾制氧气用固体加热型装置,铁丝在纯氧中剧烈燃烧,火星四射,现象不明显,有可能是氧气不纯或者铁丝表面的铁锈未除去。
(1)如图所示仪器a的名称为长颈漏斗;
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气,化学方程式为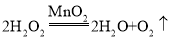 ,选择固液不加热型装置,二氧化锰为细小颗粒,因此选择B图为发生装置,氧气的收集方法为排水法或向上排空气法,因此选择的装置组合可以是BD或BE;用C装置制取氧气,选择固体加热分解制取氧气,可以选择加热分解氯酸钾制氧气,则反应的化学方程式为
,选择固液不加热型装置,二氧化锰为细小颗粒,因此选择B图为发生装置,氧气的收集方法为排水法或向上排空气法,因此选择的装置组合可以是BD或BE;用C装置制取氧气,选择固体加热分解制取氧气,可以选择加热分解氯酸钾制氧气,则反应的化学方程式为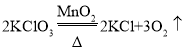 ;用制得的氧气做铁丝燃烧实验时没看见火星四射,原因可能是氧气不纯或者铁丝表面的铁锈未除去。
;用制得的氧气做铁丝燃烧实验时没看见火星四射,原因可能是氧气不纯或者铁丝表面的铁锈未除去。

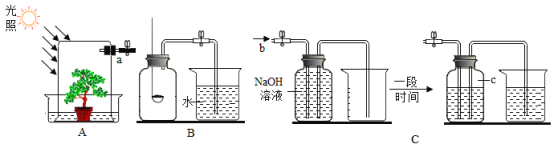
【题目】某课外小组的同学讲玻璃罩内充满纯净的二氧化碳气体,如图A所示,在光照充足的条件下,经过一段时间后,该小组同学用注射器从a处抽取气体,测定玻璃罩内气体的成分及其含量。
[查阅资料]
①植物通过光合作用吸收二氧化碳气体,放出氧气。
②氢氧化钠和氢氧化钙性质相似,其水溶液都能与二氧化碳发生反应,且没有气体物质生成。
[实验一]检验玻璃罩内是否含有二氧化碳气体?
实验步骤 | 实验现象 | 实验结论 |
抽取适量气体,注入_______中 | _____ | 玻璃罩内含有二氧化碳 |
[实验二]采用两种方法测定玻璃罩内气体中氧气的含量。
方法1:用如图B所示的装置测量气体中氧气的含量。
(1)实验前要对该装置的气密性进行检查,小明设计了一种方法,请你帮助他完成:打开止水夹,把导管末端浸没在水中,_____,若导管内水柱上升且一段时间不下降,则装置气密性良好;
(2)将抽取出的气体用排水法收集到150mL的集气瓶中,关闭止水夹,点燃红磷;
(3)待装置冷却到室温后,打开止水夹弹簧夹,烧杯中的液体进入集气瓶中,体积约为125mL.该方法所测得氧气占气体总体积的_____%。
方法2:用如图C所示的装置测量气体中氧气的含量。
(1)抽取150mL的气体,缓缓地从b处通入装置中;
(2)实验结束后,c处气体的化学式为_____,集气瓶中排出液体的体积约为75mL.该方法所测得氧气约占气体总体积的_____%。
[实验反思]通过对比,该小组同学发现,两种方法所得实验结果差距较大,其中实验结果更准确的是_____(填写“方法1”或“方法2”),另一实验方法中不合理的实验操作是_____。