题目内容
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。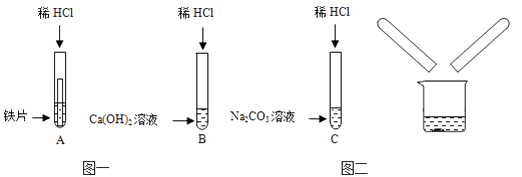
(1)写出A试管中的反应现象。
(2)写出B试管中反应的化学方程式。
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:NaCl;乙同学猜想:NaCl、CaCl2; 丙同学猜想:NaCl、CaCl2、HCl;
你的猜想:。
(4)你认为同学的猜想一定不正确,理由是。
(5)【设计实验】请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加。 | 猜想成立 |
【答案】
(1)有气泡冒出,溶液由无色变为浅绿色
(2)Ca(OH)2+ 2HCl=2H2O+CaCl2
(3)NaCl,Na2CO3
(4)丙;盐酸存在会不会有沉淀产生
(5)盐酸;有气泡冒出
【解析】盐酸和铁会反应产生气泡,同时容易会由无色变为浅绿色,试管B中的反应是Ca(OH)2+ 2HCl=2H2O+CaCl2;如果碳酸钠过量就会和氯化钙反应产生碳酸钙沉淀和氯化钠,同时还存在过量的碳酸钠,四个猜想中丙错误,因为盐酸存在会不会有沉淀产生,氯化钠是一定存在的,如果检验出物质中含有碳酸钠则我们的猜想就会正确,所以问题的关键变为然后检验碳酸钠的存在,加入盐酸如果酉气泡冒出,或者加入澄清的石灰水,如果有白色沉淀产生也说明其中含有碳酸钠。
故答案为:(1)有气泡冒出,溶液由无色变为浅绿色(2)Ca(OH)2+ 2HCl=2H2O+CaCl2(3)NaCl,Na2CO3(4)丙;盐酸存在会不会有沉淀产生;(5)盐酸;有气泡冒出(1)根据铁和稀盐酸的反应分析A试管中的现象
(2)氢氧化钙和盐酸反应生成氯化钙和水
(3)根据反应现象分析混合物的组成
(4)根据碳酸钙和盐酸的反应分析错误的猜想
(5)根据碳酸钠溶液呈碱性能使无色酚酞变红解答