题目内容
【题目】下列各组物质,能在溶液中大量共存,且形成无色溶液的是
A.NaOH Na2SO4 NH4ClB.NaHCO3 H2SO4 NaCl
C.Na2SO4 FeCl3 KClD.HCl KNO3 K2SO4
【答案】D
【解析】
A、氢氧化钠和氯化铵不能共存,二者会反应生成氯化钠、氨气和水。A错误;
B、硫酸和碳酸氢钠不能共存,二者会反应生成硫酸钠、水和二氧化碳。B错误;
C、氯化铁溶液呈黄色,不符合题意。C错误;
D、盐酸、硝酸钾、硫酸钾可以共存,且溶液呈无色。D正确。
故选D。

【题目】化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生,是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了。
(1)【分析】氢氧化钠变质的原因是(用化学方程式表示)。
(2)【提出问题1】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性。
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论。
实验步骤 | 实验现象 | 实验结论 |
①取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡。 | 有白色沉淀产生。 | 说明原溶液中一定含有 |
②取①试管中的上层清液滴加酚酞试液。 | 溶液变红色。 | 则溶液中一定含有。 |
(3)【实验结论】同学得出的结论是:氢氧化钠溶液变质(填“部分”或“全部”)。
(4)【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。请你帮助他们解决下列问题:
①除去氢氧化钠溶液中存在的上述杂质可加入适量的。
②借助于可判断盐酸和氢氧化钠溶液恰好完全反应。
(5)[提出问题2]该溶液的变质程度如何呢?
实验步骤:取该溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,所加盐酸质量与产生气体质量关系如图: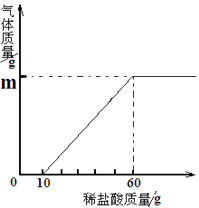
试计算:生成气体m的值(请写出解题过程)。
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。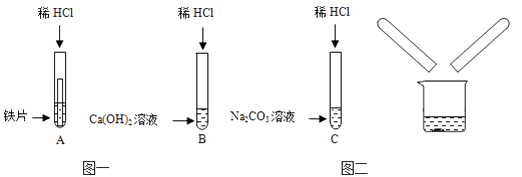
(1)写出A试管中的反应现象。
(2)写出B试管中反应的化学方程式。
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:NaCl;乙同学猜想:NaCl、CaCl2; 丙同学猜想:NaCl、CaCl2、HCl;
你的猜想:。
(4)你认为同学的猜想一定不正确,理由是。
(5)【设计实验】请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加。 | 猜想成立 |