题目内容
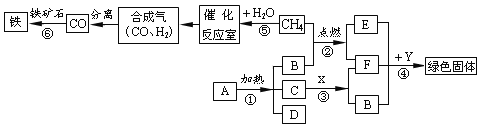
【题目】实验室里有一包含有NaCl和CaCl2两种固体的混合物,现准备将它们分离开,设计如下方
案.请完成下列问题:

(1)步骤②中发生反应的化学方程式是_____ _.操作a的名称是____ __.
(2)步骤③中加适量试剂是___ __ _.(3)在步骤④操作b中,玻璃棒的作用是__ _.
【答案】(1)Na2CO3+CaCl2═CaCO3↓+2NaCl 过滤
(2)HCl
(3)使液体受热均匀,防止液滴飞溅.
【解析】
试题分析:(1)NaCl和CaCl2两种固体都易溶解于水,如果将它们分离,必须先转化为沉淀,,因为钠盐易溶解于水,所以应该把CaCl2转化为碳酸钙沉淀,故加入Na2CO3溶液,反应的化学方程式为:
Na2CO3+CaCl2═CaCO3↓+2NaCl 通过过滤可以把难溶解于水的固体与液体分离
(2)因为向混合物A中加入了过量的Na2CO3溶液,所以溶液B中有剩余的Na2CO3溶液,要把它转化为NaCl溶液,故加入稀盐酸
(3)蒸发时要用到玻璃棒,它的作用是使液体受热均匀,防止液滴飞溅

练习册系列答案
相关题目