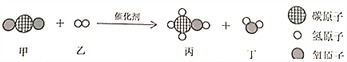
题目内容
【题目】已知:在650℃时,CuSO4分解为CuO与气体。在1400℃时,CuO受热发生如下反应:4CuO![]() 2Cu2O+O2↑,现将16gCuSO4高温加热一段时间。冷却后称量剩余固体为7.6g。下列说法错误的是( )
2Cu2O+O2↑,现将16gCuSO4高温加热一段时间。冷却后称量剩余固体为7.6g。下列说法错误的是( )
A. 剩余固体为混合物
B. 产生的气体中,硫、氧的质量比为4:13
C. 剩余固体中含6.4g铜元素
D. 剩余固体用足量CO还原,可产生CO23.3g
【答案】B
【解析】
A、假设为650℃时,CuSO4分解为CuO与气体,
设:完全分解生成的固体的质量为x。
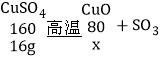
![]() x=8g;剩余固体为7.6g,说明氧化铜也部分分解。所以剩余固体一定是混合物,故A正确;
x=8g;剩余固体为7.6g,说明氧化铜也部分分解。所以剩余固体一定是混合物,故A正确;
B、根据铜元素守恒,设:混合物中氧化铜的质量为a,则氧化亚铜的质量为7.6g﹣a;![]() a=4g;氧化亚铜的质量为7.6g﹣4g=3.6g。产生的气体中,硫、氧的质量比为
a=4g;氧化亚铜的质量为7.6g﹣4g=3.6g。产生的气体中,硫、氧的质量比为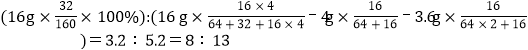 故B错误;
故B错误;
C、根据质量守恒定律可知,剩余固体中含铜元素质量=硫酸铜中铜元素质量=![]() ,故C正确;
,故C正确;
D、剩余固体含氧元素的质量=![]() ;剩余固体用足量CO还原,由于二氧化碳中的氧元素一半来自固体中的氧元素,所以可产生CO2=
;剩余固体用足量CO还原,由于二氧化碳中的氧元素一半来自固体中的氧元素,所以可产生CO2=![]() ,故D正确。故选B。
,故D正确。故选B。

 口算题天天练系列答案
口算题天天练系列答案【题目】学习了CO2的有关知识之后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2![]() 2MgO+C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
2MgO+C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
(提出猜想)钠能发生类似于CO2与镁的反应,可能的化学方程式为:_____。
(实验)将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧。
(查阅资料)
(1)Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH。
(2)Ba(OH)2溶于水而BaCO3不溶于水。
(3)Na2CO3的存在会干扰NaOH的检测。
基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C;②_____、C;③NaOH、C;④Na2O、Na2CO3、C。
通过理论分析,猜想_____(填序号)肯定是错误的,理由是_____。
(验证猜想)
步骤 | 实验操作 | 主要实验实验现象 | 结论 |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 狂想④正确 |
(2) | 取少量(1)所得上层清液,加入过量的BaCl2溶液 | _____ | |
(3) | 取(2)所得少量上层清液,加入_____ | 溶液变红色 |
步骤(2)中BaCl2溶液发生反应的化学方程式:_____。