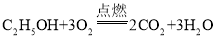题目内容
【题目】某K2CO3样品中,可能含有NaCl、Na2CO3,现取6.9g样品加入50g稀盐酸中,经测定,恰好完全反应,最终得到室温下不饱和溶液54.7g,则下列有关说法正确的是( )。
A.该反应生成了4.4g 二氧化碳气体
B.所加稀盐酸溶质质量分数为3.65%
C.所得溶液中溶质的总质量为7.45g
D.若样品中含有Na2CO3,则样品中也一定含NaCl
【答案】CD
【解析】
根据质量守恒定律,该反应生成的二氧化碳气体质量为6.9g+50g-54.7g=2.2g;
设50g稀盐酸中溶质质量为z,则
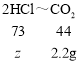
![]()
z=3.65g;
故所加稀盐酸溶质质量分数为![]() ;
;
50g稀盐酸中水的质量为50g-3.65g=46.35g,反应过程水不参加反应,设反应生成的水的质量为m,则
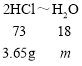
![]()
m=0.9g;
则所得溶液中溶质的总质量为54.7g-46.35g-0.9g=7.45g;
假设样品全部为K2CO3,设6.9g K2CO3完全反应生成二氧化碳的质量为x,则
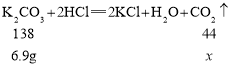
![]()
x=2.2g;
设6.9g Na2CO3完全反应生成二氧化碳的质量为y,则
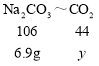
![]()
y=2.86g>2.2g;
故样品可能全部是K2CO3,或者K2CO3、NaCl、Na2CO3都有,若样品中含有Na2CO3,则样品中也一定含NaCl;
A、根据质量守恒定律,该反应生成的二氧化碳气体质量为6.9g+50g-54.7g=2.2g,说法错误;
B、所加稀盐酸溶质质量分数为7.3%,说法错误;
C、所得溶液中溶质的总质量为7.45g,说法正确;
D、若样品中含有Na2CO3,则样品中也一定含NaCl,说法正确;
故选:D。

练习册系列答案
相关题目