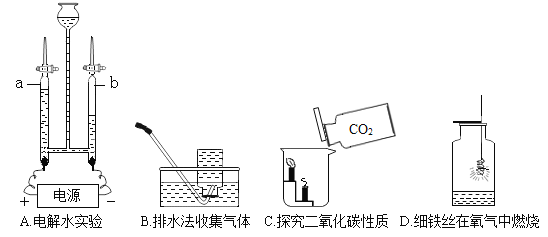
题目内容
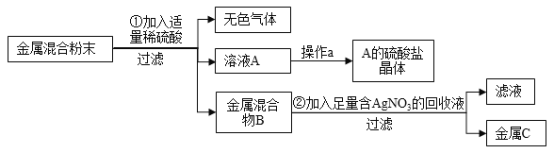
【题目】某合金的主要成分为Zn、Fe、Cu及这三种金属的氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
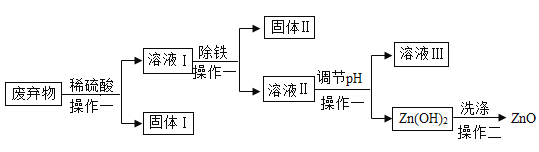
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)操作一的名称是_______________________________。
(2)在溶液I中加入过量的锌,固体II中可能有的固体是_______________________。
(3)调节pH可用NaOH,但不能过量,其原因是_______________________。
【答案】过滤 Zn、Fe、Cu 氢氧化锌能与氢氧化钠反应生成可溶性盐,从而得不到氢氧化锌沉淀
【解析】
(1)由图可知,操作一实现了固液分离,故操作一是过滤;
(2)合金的主要成分为Zn、Fe、Cu及这三种金属的氧化物,加入稀硫酸,锌能与稀硫酸反应生成硫酸锌和氢气,铁能与稀硫酸反应生成硫酸亚铁和氢气,铜与稀硫酸不反应,可能含有氧化铜,氧化铜能与稀硫酸反应生成硫酸铜和水,过滤,得到的溶液Ⅰ中可能含有硫酸锌、硫酸亚铁、硫酸铜,在溶液I中加入过量的锌,锌与硫酸亚铁反应生成硫酸锌和铁,锌与硫酸铜反应生成硫酸锌和铜,锌过量,故固体II中可能有的固体是:Zn、Fe、Cu;
(3)调节pH可用NaOH,硫酸锌能与氢氧化钠反应生成氢氧化锌,但不能过量,其原因是:氢氧化锌能与氢氧化钠反应生成可溶性盐,从而得不到氢氧化锌沉淀。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】某化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制备氧气。但实验中发现制得的气体有刺激性气味,于是兴趣小组在老师的指导下对该气体成分进行探究。
[提出问题]刺激性气味的气体是什么呢?
[猜想与假设]猜想一:该气体为臭氧(O3);
猜想二:该气体为HCl;
猜想三:该气体为Cl2。
同学们认为不需要验证就可以判断猜想_________是错误的;理由是__________。
[查阅资料]
(1)![]() ;
;
(2)HClO具有强氧化性和漂白性,使有色物质褪色
(3)臭氧在二氧化锰存在的情况下极易分解产生氧气。
[实验探究]
查阅资料后大家认为猜想一是错误的,理由是__________。他们为了验证剩下的猜想继续做实验:
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 取氯酸钾和二氧化锰的混合物放入试管中加热;将蘸有硝酸银溶液的玻璃棒伸入试管口 | _________ | 剩下的猜想正确 |
2 | 再将湿润的蓝色石蕊试纸悬于试管口 | 湿润的蓝色石蕊试纸先变红色,后变成无色 |
[反思与拓展]
(1)自来水厂常用漂白粉杀菌消毒[主要成分的化学式为Ca(ClO)2].在水中起杀菌消毒作用的离子是_____ (填离子符号)
(2)MnO2不仅能作催化剂还可以作反应物,实验室通常用MnO2与浓盐酸共热制取Cl2,同时还生成MnCl2和一种常见的液体。请完成该反应的化学方程式:_________。