题目内容
【题目】我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础,生产生活中铁和铁的化合物也有着广泛的应用。
(一)铁的广泛应用
(1)“加铁酱油”中的铁指的是_____(填“单质”或“元素”)。
(2)铁制炊具加热食物,说明铁具有的性质是_____。
(3)铁与铬、镍等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料。以上叙述中没有涉及到_____(填字母)。
A 合金 B 无机非金属材料 C 合成材料 D 复合材料
(二)铁锈成分的探究
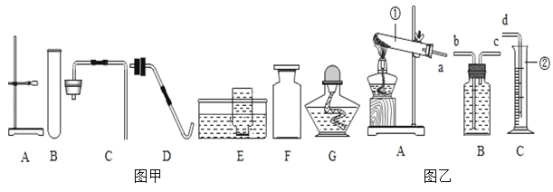
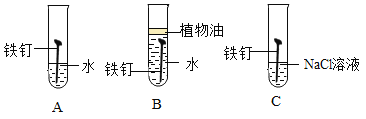
(1)下图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是_____(选填序号)。
(2)铁生锈的主要过程为:Fe![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3xH2O
Fe2O3xH2O
次要过程为:Fe![]() FeCO3
FeCO3
写出Fe→Fe(OH)2反应的化学方程式_____。
(3)铁锈组分的确定
某铁锈成分为Fe2O3xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用下图装置进行实验。

(查阅资料)①Fe2O3xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2
②温度高于500℃时铁的氧化物才能被CO还原。
(1)装配好实验装置后,首先要_____。
(2)装置A中的反应为:H2C2O4(草酸)![]() CO↑+CO2↑+H2O通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放_____(选填序号)。
CO↑+CO2↑+H2O通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放_____(选填序号)。
a.浓硫酸 b.氢氧化钠溶液
(3)现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g。则样品中FeCO3的质量m(FeCO3)=_____g。
(4)若缺少G装置,Fe2O3xH2O中x的值会_____。(选填“偏大”、“偏小”、“不变”)
(三)炼铁过程的探究
(1)进行上述实验时,应先点燃A装置中的酒精灯,后对D玻璃管加热,原因是_____。
(2)将上述300℃完全分解后的D装置中剩余固体继续升温,当温度高于500℃时,铁的氧化物全部被CO还原得到铁的质量_____克。(计算过程)
【答案】元素 导热性 B C 2Fe+O2+2H2O=2Fe(OH)2 检查装置气密性 b 5.8 偏大 排出装置中的空气,防止发生爆炸 14
【解析】
解:(一)铁的广泛应用
1、“加铁酱油”中的铁指的是元素。
故填:元素。
2、铁制炊具加热食物,说明铁具有的性质是导热性。
故填:导热性。
3、铁与铬、镍等金属熔合可形成“不锈钢”,不锈钢属于合金,聚乙烯纤维属于合成材料,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料属于复合材料。
故填:B。
(二)铁锈成分的探究
1、B中铁钉与氧气隔绝,不容易生锈,A中铁钉和水、氧气接触,容易生锈,C中铁钉与水和氧气接触,容易生锈,同时氯化钠溶液能够促进铁钉生锈,因此最先观察到铁锈的是C。
故填:C。
2、铁和水、氧气反应生成氢氧化亚铁的化学方程式为:2Fe+O2+2H2O=2Fe(OH)2。
故填:2Fe+O2+2H2O=2Fe(OH)2。
3、(1)装配好实验装置后,首先要检查装置气密性。
故填:检查装置气密性。
(2)洗气瓶B中应盛放氢氧化钠溶液,用来吸收二氧化碳。
故填:b。
(3)设碳酸亚铁质量为x,
装置F增重2.2g,说明碳酸亚铁分解生成了2.2g二氧化碳,
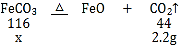
![]() =
=![]() ,
,
x=5.8g,
故填:5.8。
(4)若缺少G装置,空气中的水蒸气和二氧化碳会进入F装置,导致计算的碳酸亚铁质量偏大,从而导致Fe2O3xH2O质量偏小,而通过E装置测定的结晶水质量不变,从而导致Fe2O3xH2O中x的值会偏大。
故填:偏大。
(三)炼铁过程的探究
1、进行上述实验时,应先点燃A装置中的酒精灯,后对D玻璃管加热,原因是排出装置中的空气,防止发生爆炸。
故填:排出装置中的空气,防止发生爆炸。
2、Fe2O3的质量为:25.4g﹣3.6g﹣5.8g=16g,
16g氧化铁中铁元素质量为:16g×![]() =11.2g,
=11.2g,
5.8g碳酸亚铁中铁元素质量为:5.8g×![]() =2.8g,
=2.8g,
将上述300℃完全分解后的D装置中剩余固体继续升温,当温度高于500℃时,铁的氧化物全部被CO还原得到铁的质量为:11.2g+2.8g=14g,
故填:14。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】化学兴趣小组的同学按图示装置及步骤验证氢氧化钠的化学性质。
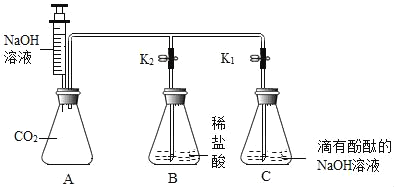
(实验步骤)
Ⅰ.将注射器内的液体注入A中的锥形瓶。
Ⅱ.打开K1,观察到C中部分红色溶液沿导管倒溶液吸入A,片刻后回流停止。
Ⅲ.打开K2,观察到B中溶液倒吸入A、C中,液面稳定后观察到A中溶液仍为红色,C中溶液变为无色。
同学们对相关问题分组展开如下探究。
探究环节 | 甲组的探究 | 乙组的探究 |
(提出问题) | A中使酚酞变为红色的物质是什么? | C中溶液为什么变成无色? |
(做出猜想) | 猜想一:Na2CO3 猜想二:Na2CO3和NaOH | 猜想一:实验过程中酚酞变质了 猜想二:溶液中的NaOH反应完了 |
(实验验证) | 小鹏取少量A中溶液于试管中,向其中滴加过量BaCl2溶液,若观察到_____,证明猜想二成立。小丽认为用Ba(OH)2溶液也可证明猜想二成立,小鹏认为小丽的方案不合理,理由是_____。 | (1)取少量C中溶液于试管中,向其中滴加NaOH溶液,溶液又变为红色,证明猜想一不成立。 (2)用pH试纸测定C中溶液的酸碱度,若pH_____,证明猜想二成立。 |
(反思交流)(1)甲、乙两组同学的实验证明了NaOH能与稀盐酸、CO2发生反应;A中溶液里一定还存在NaCl.写出NaOH与CO2发生反应的化学方程式_____。
(2)(实验步骤)Ⅱ中的现象_____(填“能”或“不能”)证明NaOH与CO2发生了反应。
(拓展迁移)对于无明显现象的化学反应,可通过检验有新物质生成或检验_____的方法来证明反应发生了。