题目内容
【题目】将6.5g含有一种杂质的锌粉与足量的稀硫酸反应,生成0.18g氢气,则该锌粉中混有的杂质是_____(填“铜”或“铝”);将纯净的锌粉加入到含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则滤液中一定含有_____,若滤渣中含有两种金属,则滤液中可能含有_____.
【答案】铜 硝酸锌 硝酸铜
【解析】
锌、铝和稀硫酸反应的化学方程式及其质量关系为:![]() ,
,![]() 。 由以上质量关系可知,6.5g锌和稀硫酸完全反应时生成0.2g氢气,如果锌中含有铝时反应生成的氢气质量应该大于0.2g,因此该锌粉中混有的杂质是铜;
。 由以上质量关系可知,6.5g锌和稀硫酸完全反应时生成0.2g氢气,如果锌中含有铝时反应生成的氢气质量应该大于0.2g,因此该锌粉中混有的杂质是铜;
将纯净的锌粉加入到含有Cu(NO3)2和AgNO3的混合溶液中,锌先与硝酸银反应生成硝酸锌和银,硝酸银完全反应后,锌再与硝酸铜反应生成硝酸锌和铜,充分反应后过滤,若滤液中只含有一种溶质,则滤液中一定含有硝酸锌;
若滤渣中含有两种金属,滤渣一定是银和铜,则滤液中一定含有硝酸锌,可能含有硝酸铜。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
实验编号 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 12.5 | 25.0 | 37.5 | 50.0 | 62.5 |
生成CO2的质量/g | 4.4 | 7.5 | 13.2 | 17.6 | 17.6 |
分析上述实验数据并回答:
(1)实验编号为_______的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为__________。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)________。
【题目】实验室中有一瓶标签受损的无色液体,如图所示。这瓶无色液体是什么呢?实验员老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种。
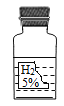
(1)大家讨论后一致认为不可能是蒸馏水,理由是_____。
(2)为确定该液体成分,同学们继续进行了如下实验探究
实验操作 | 实验现象 | 实验结论 |
步骤一:取该液体适量于试管中,向其中加入少量_____粉末。 | 没有气泡生成 | 该液体不是过氧化氢溶液 |
步骤二:取该液体适量于试管中,向其中滴加少量氯化钡溶液。 | ___ | 该液体是稀硫酸 |
(3)小亮为了进一步证明结论是正确的,他选择紫色石蕊试液进行实验,实验中看到的现象是_____,证明实验结论成立。
(反思交流)
(1)大家认为标签受损的原因可能是_____。
(2)写出步骤二的反应方程式_____。