题目内容
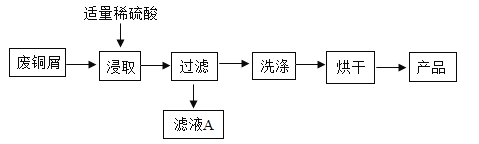
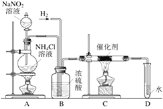
【题目】硫酸亚铁铵是一种重要的化工原料,用途十分广泛。硫酸亚铁铵俗称摩尔盐,下图为制取摩尔盐过程的示意图。

请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH_____7(填“>”、“<”或“=”)。
(2)步骤②中,过滤操作,需要的玻璃仪器有烧杯、玻璃棒、_____,能用加热蒸发冷却的方法析出,说明摩尔盐的溶解度_____;
(3)废铁屑的主要成分是铁,同时含有少量氧化铁。请写出①中反应的化学方程式_____(写出其中一个化学反应方程式)
(4)步骤②所得滤液中一定含有的溶质是_____;
(5)能用酒精洗涤的原因_____。
【答案】> 漏斗 随温度的降低而减小 Fe+H2SO4=FeSO4+H2↑(合理即可) 硫酸亚铁铵(其他合理答案也得分) 摩尔盐不溶于酒精
【解析】
(1)碳酸钠溶液显碱性,pH>7,能除去油污;
(2)过滤操作中,需要的玻璃仪器有烧杯、玻璃棒、漏斗,能用加热结晶的方法析出说明摩尔盐的溶解度随温度的降低而减小;
(3)废铁屑中有铁、氧化铁,铁与稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水,铁还能与硫酸铁反应生成硫酸亚铁,方程式为Fe+H2SO4═FeSO4+H2↑;3H2SO4+Fe2O3═Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe═3FeSO4;
(4)从硫酸亚铁铵的溶液中结晶析出硫酸亚铁铵,滤液中一定含有硫酸亚铁铵;
(5)由于摩尔盐不溶于酒精,所以能用酒精洗涤摩尔盐.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目