题目内容
【题目】金属及其化合物的应用及制备。
(一)铁、铜的广泛应用
(1)航母用钢要具有低磁性。下列具有磁性的是______(填序号)。
A FeO B Fe3O4 C Fe2O3
(2)“航母”螺旋浆可由特制的铜合金制造。铜合金比铜的硬度______(填“大”或“小”)。铜比铁在海水中耐腐蚀的原因是______。
(3)生铁炼钢时,硅(Si)与氧化亚铁在高温条件下转化为二氧化硅和铁,该反应的化学方程式为______。
(二)硫酸铜的制备
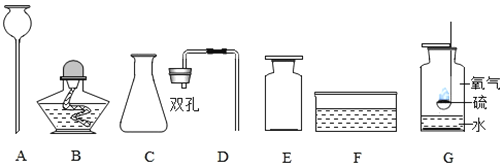
下图为某兴趣小组用含较多杂质的铜粉制取硫酸铜晶体[CuSO4·5H2O]的两种实验方案。
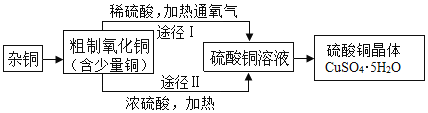
(4)制备中需过滤得到硫酸铜晶体。过滤时需要的玻璃仪器有烧杯、玻璃棒和___。
(5)灼烧杂铜除去其中的杂质,产生CO2和少量CO。灼烧后的产物为CuO及少量Cu。产物中含有Cu的可能原因是______(填序号)。
A灼烧过程中,部分氧化铜与一氧化碳反应
B灼烧不充分,铜未被完全氧化
C该条件下铜无法被氧气氧化
(6)方案Ⅰ通入氧气,少量Cu转化为CuSO4。该反应的化学方程式为____。
(7)方案Ⅱ中加入浓硫酸发生的反应有Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
方案Ⅰ优于方案Ⅱ的理由是____。
(三)波尔多液的制备及组成测定
波尔多液是常见的杀菌剂,为天蓝色碱性悬浊液。以硫酸铜、生石灰及水为原料,制备波尔多液。为测定从波尔多液中分离出的天蓝色固体[CuSO4·aCu(OH)2·bCa(OH)2·cH2O]的组成,设计如下实验:
(实验Ⅰ)称取64.4g天蓝色固体,加入足量稀HNO3使其完全溶解,再加入过量Ba(NO3)2溶液,过滤,洗涤干燥得白色固体23.3g。
(8)判断Ba(NO3)2溶液已过量的方法是:静置,向上层清液中滴加____溶液,无现象。
(9)不能在铁制容器中配波尔多液。请用化学方程式解释原因____。
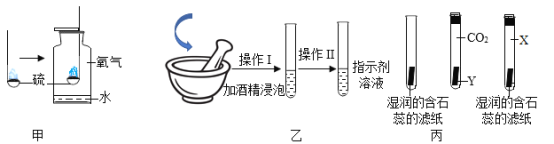
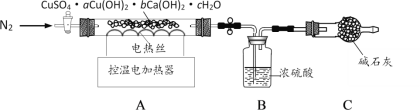
(实验Ⅱ)另取64.4g天蓝色固体,用下图装置进行热分解实验:
(资料)①CuSO4、Cu(OH)2、Ca(OH)2在一定温度下能受热分解,分别生成两种氧化物,分解过程中各元素的化合价均不改变。
②天蓝色固体在110℃时,完全失去结晶水。
③Cu(OH)2在100℃时分解完全。CuSO4和Ca(OH)2在580℃左右时开始分解,到650℃时均能分解完全。
④浓硫酸可用于吸收SO3。
(10)按图连接好装置,实验前要先__________。
(11)控制温度在110℃充分加热,测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2 g。最终剩余固体中的成分是_________。
(12)整个加热过程中,天蓝色固体分解生成水的总质量为_________g。
(13)天蓝色固体CuSO4·aCu(OH)2·bCa(OH)2·cH2O中,a∶b∶c=______。
【答案】B 大 铜的金属活动性比铁弱 Si+2FeO![]() SiO2+2Fe 漏斗 AB 2Cu+O2+2H2SO4=2CuSO4+2H2O 不会产生污染大气的气体 硝酸钡 Fe+CuSO4=FeSO4+Cu 检查装置的气密性 CuO和CaO 18 1:4:5
SiO2+2Fe 漏斗 AB 2Cu+O2+2H2SO4=2CuSO4+2H2O 不会产生污染大气的气体 硝酸钡 Fe+CuSO4=FeSO4+Cu 检查装置的气密性 CuO和CaO 18 1:4:5
【解析】
(1)航母用钢要具有低磁性,Fe3O4具有磁性,故选B;
(2)合金的硬度比组成它的纯金属的硬度大,铜合金比铜的硬度大;铜比铁在海水中耐腐蚀,是因为铜的金属活动性比铁弱;
(3)硅(Si)与氧化亚铁在高温条件下转化为二氧化硅和铁,反应的化学方程式为:Si+2FeO![]() SiO2+2Fe。
SiO2+2Fe。
(4)过滤时需要的玻璃仪器有烧杯、玻璃棒和漏斗。
(5)铜在加热条件下易生成氧化铜,氧化铜稳定,难以分解,在灼烧过程中部分氧化铜被一氧化碳还原或者灼烧不充分铜未被完全氧化都会导致杂铜经灼烧后得到的产物含有少量铜,故选AB;
(6)方案Ⅰ通入氧气,少量Cu转化为CuSO4,即铜在氧气和稀硫酸作用下反应生成硫酸铜和水,该反应的化学方程式为 2Cu+O2+2H2SO4=2CuSO4+2H2O;
(7)方案Ⅱ中加入浓硫酸发生的反应有Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,方案Ⅰ优于方案Ⅱ的理由是不会产生污染大气的气体;
CuSO4+SO2↑+2H2O,方案Ⅰ优于方案Ⅱ的理由是不会产生污染大气的气体;
(8)CuSO4与Ba(NO3)2反应生成硫酸钡沉淀和硝酸铜,判断Ba(NO3)2溶液已过量就是检验硫酸根离子无剩余,所以对应的方法是:静置,向上层清液中滴加硝酸钡溶液,无现象。
(9)不能在铁制容器中配波尔多液。是因为铁和硫酸铜反应生成硫酸亚铁和铜,对应的化学方程式为:Fe+CuSO4=FeSO4+Cu;
(10)按图连接好装置,为防止装置漏气,影响实验的准确性,实验前要先检查装置的气密性;
(11)根据“CuSO4、Cu(OH)2、Ca(OH)2在一定温度下能受热分解,分别生成两种氧化物,分解过程中各元素的化合价均不改变”可知,Cu(OH)2在100℃时分解完全生成CuO和H2O,CuSO4和Ca(OH)2在580℃左右时开始分解,到650℃时均能分解完全,CuSO4完全分解生成CuO和SO3,Ca(OH)2完全分解生成CaO和H2O,控制温度在110℃充分加热,测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2 g,浓硫酸可用于吸收水和SO3,终剩余固体中的成分是CuO和CaO;
(12)CuSO4与Ba(NO3)2反应生成硫酸钡沉淀和硝酸铜,称取64.4g天蓝色固体,加入足量稀HNO3使其完全溶解,再加入过量Ba(NO3)2溶液,过滤,洗涤干燥得白色固体23.3g,沉淀为硫酸钡;
设:硫酸铜的质量为x,对应的硫酸铜分解生成的三氧化硫的质量为y,硫酸铜对应的分解产物氧化铜的质量为z。
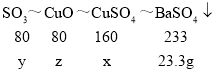
![]() x=16g;
x=16g;
![]() y=8g;
y=8g;
![]() z=8g;
z=8g;
浓硫酸可用于吸收水和SO3.所以测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2g。整个加热过程中,天蓝色固体分解生成水的总质量为10.8g+15.2g-8g=18g;再升温至650℃充分加热,B装置又增重了15.2g,由于其中有吸收的8g三氧化硫,所以来自于氢氧化钙的分解生成水的质量为15.2g-8g=7.2g;
设:氢氧化钙的质量为a,对应的氧化钙的质量为b;
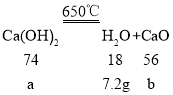
![]() a=29.6g;
a=29.6g;
![]() b=22.4g
b=22.4g
则氢氧化铜对应生成的氧化铜的质量=64.4g-10.8g-15.2g-z-b=64.4g-10.8g-15.2g-8g-22.4g=8g;
设:对应的分解生成的水的质量为c,对应的氢氧化铜的质量为d。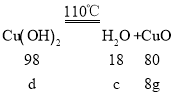
![]() c=1.8g;
c=1.8g;
![]() d=9.8g;则结晶水的质量=18g-7.2g-1.8g=9g;天蓝色固体CuSO4aCu(OH)2bCa(OH)2cH2O中,a:b:c=
d=9.8g;则结晶水的质量=18g-7.2g-1.8g=9g;天蓝色固体CuSO4aCu(OH)2bCa(OH)2cH2O中,a:b:c=![]() 。
。

【题目】以下是某研究小组探究影响化学反应速率快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | / | 125 | 148 |
④ | 30 | 12 | 90 | / | 125 | 82 |
(1)通过实验①和②对比可知,化学反应快慢与_____有关;
(2)通过对比实验_____和_____可知(填序号),化学反应快慢与温度的关系是_____。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是_____。
(4)写出该反应的化学方程式_____。
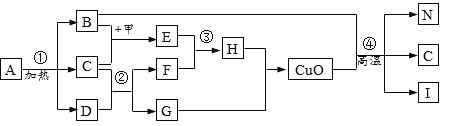
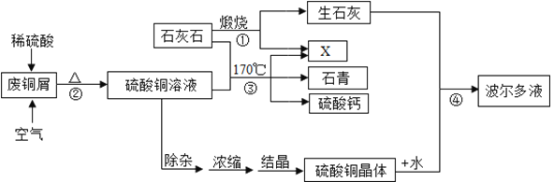
【题目】某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下:
一、产品制备
(1)流程图中X的化学式为______;
(2)反应②分两步进行,化学方程式分别为:第一步______,第二步______;
(3)硫酸铜的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为______;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质; Ⅱ是______。
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其总反应化学方程式为______。
二、组成测定
资料:石青的化学式是aCuCO3·bCu(OH)2,已知Cu(OH)2和CuCO3都能受热分解,分别生成两种氧化物,其中Cu(OH)2的分解温度为66℃到68℃,CuCO3的分解温度为200℃到220℃。
为测定其组成,小组同学称取石青样品34.6g,用下图装置进行实验。

(5)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为______。
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g。通过计算可得 a︰b=______。
(7)若缺少F装置,测得的a︰b的值会______(选填“偏大”、“偏小”、“不变”)。
三、产物探究
取22.2g样品,对固体进行热分解实验,测定剩余固体质量与分解温度之间关系如图。请回答下列问题:
(8)0~66℃固体质量没有发生变化的原因可能是_______。
(9)m=________。
(10)若将mg剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:______。