题目内容
【题目】探究镁、锌、铁、铜四种金属能否与酸反应
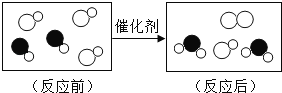
(1)进行了如图所示的实验,请回答问题:
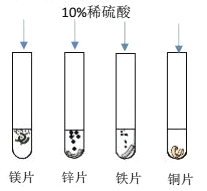
根据四支试管中产生的实验现象的不同可获知四种金属的活动性由强到弱的顺序是______,当稀硫酸过量时,装有铁片的试管中反应后的溶液含有的离子是_______(用离子符号表示)。
(2)金属与足量的酸反应存在各种规律,请你分析下表中的数据,找到对应关系:
lg金属与足量稀盐金属与足量(均生成+2价金属的盐溶液) | 镁 | 锌 | 铁 |
金属的相对原子质量 | 24 | 65 | 56 |
产生氢气的质量(g) | 2/24 | 2/65 | 2/56 |
你发现的规律 | _______ | ||
(拓展应用)
有两种外观类似黄金的①Cu-Zn合金和②Cu-Ag制品,若实验室只提供一瓶稀硫酸和必要仪器。
(3)你认为能测出合金________(填序号)中铜的质量分数;
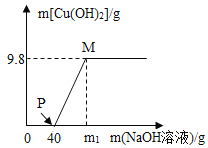
(4)取上述(3)中所选合金粉末20g放人烧杯中,加人50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g,则:
①产生氢气的质量是________;
②该合金中铜的质量分数为_____________。
【答案】Mg>Zn>Fe>Cu Fe2+、SO42-、H+ 质量相等,化合价相同的金属与足量的酸反应,相对原子质量越小生成的氢气越多 ① 0.2g 67.5%
【解析】
观察与思考一:
(1)与硫酸反应最剧烈的是镁,反应较快的是锌,反应最慢的是铁,不反应的是铜,故四种金属的活性顺序是:Mg>Zn>Fe>Cu;铁和硫酸反应生成硫酸亚铁和氢气,又因为硫酸过量,故反应后溶液中的离子有:Fe2+、SO42-、H+;
(2)根据表格中的信息可知,质量相等,化合价相同的金属与足量的酸反应,相对原子质量越小生成的氢气越多;
I 拓展应
(3)要金属活动性顺序中Zn在氢的前面能和盐酸或稀硫酸反应,Cu在氢的后面,不能和盐酸或稀硫酸反应,Ag在氢的后面,不能和盐酸或稀硫酸反应,故能测出Cu-Zn合金中铜的质量分数;
(4)生成氢气的质量为:
20g+50g-69.8g=0.2g
设生成0.2g氢气需要Zn的质量为x
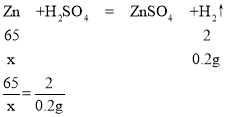
x=6.5g
该合金中铜的质量分数为:![]() ×100%=67.5%。
×100%=67.5%。
故答案为:
(1)Mg>Zn>Fe>Cu;Fe2+、SO42-、H+;
(2)质量相等,化合价相同的金属与足量的酸反应,相对原子质量越小生成的氢气越多;
[拓展应用]
(3)①;
(4)①0.2g;②67.5%。

 阅读快车系列答案
阅读快车系列答案【题目】如表中,有关量的变化图象与其对应叙述相符的是( )
A | B | C | D |
|
|
|
|
向接近饱和的NaCl溶液中加入固体NaCl | 向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2 | 向Na2CO3溶液中加入一定溶质质量分数的NaOH溶液 | 等质量、等质量分数的H2SO4溶液与NaOH溶液混合 |
A.A B.B C.C D.D