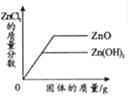题目内容
【题目】如表中,有关量的变化图象与其对应叙述相符的是( )
A | B | C | D |
|
|
|
|
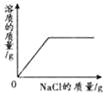
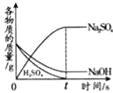
向接近饱和的NaCl溶液中加入固体NaCl | 向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2 | 向Na2CO3溶液中加入一定溶质质量分数的NaOH溶液 | 等质量、等质量分数的H2SO4溶液与NaOH溶液混合 |
A.A B.B C.C D.D
【答案】D
【解析】
试题分析:A、向接近饱和的氯化钠溶液中加入氯化钠固体至饱和,溶液质量先增大,后不再改变,但是溶质的质量不会从零开始,故A错误;B、ZnO+2HCl=ZnCl2+H2O,Zn(OH)2+2HCl=ZnCl2+2H2O可知,等质量的固体与盐酸反应时生成的氯化锌质量不相等,生成的水的质量不相等,所以溶质质量分数也不会相等,故B错误;C、碳酸钠溶液显碱性,所以溶液的起点不会从7开始,故C错误;D、每98份质量的硫酸和80份质量的氢氧化钠反应会生成142份质量的硫酸钠和36份质量的水,所以硫酸、氢氧化钠的中逐渐减少,但是硫酸先反应完,硫酸钠质量逐渐增大,然后不变,故D正确。

【题目】在学习酸的化学性质后,同学们做了如图所示的A、B两个实验:
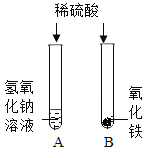
(1)A试管中发生反应的化学方程式 。向B试管中的加入足量的稀硫酸,观察到的现象是 。
(2)实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中,片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化铁。
小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质?小红、小军对此进行探究。
【实验讨论】
①小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为 。
②小军认为滤液中不可能有Fe2(SO4)3,理由是 。
【提出猜想】
猜想Ⅰ:Na2SO4 NaOH
猜想Ⅱ:
【设计实验】
实验操作 | 实验现象 | 结论 |
取少量滤液于试管中,向其中滴加酚酞试液 |
| 猜想Ⅰ成立 |