题目内容
【题目】下列制取物质的设计中,不合理的是( )
A.CaCO3![]() CaO
CaO![]() Ca(OH)2
Ca(OH)2![]() NaOH溶液
NaOH溶液
B.Cu![]() CuO
CuO![]() CuSO4溶液
CuSO4溶液![]() Cu(OH)2沉淀
Cu(OH)2沉淀
C.Fe2O3![]() FeCl3
FeCl3 ![]() Fe (OH)3
Fe (OH)3
D.Ba(OH)2![]() BaCl2溶液
BaCl2溶液![]() BaCO3沉淀
BaCO3沉淀
【答案】D
【解析】
A、高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,该选项设计合理;
B、加热条件下,铜和氧气反应生成氧化铜,氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,该选项设计合理;
C、氧化铁和稀盐酸反应生成氯化铁和水,氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,该选项设计合理;
D、氢氧化钡和稀盐酸反应生成氯化钡和水,氯化钡不能和二氧化碳反应,因此不能制取碳酸钡,该选项设计不合理。
故选:D。

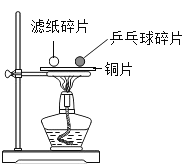
【题目】探究镁、锌、铁、铜四种金属能否与酸反应
(1)进行了如图所示的实验,请回答问题:
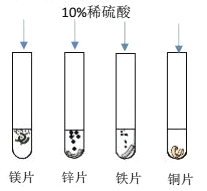
根据四支试管中产生的实验现象的不同可获知四种金属的活动性由强到弱的顺序是______,当稀硫酸过量时,装有铁片的试管中反应后的溶液含有的离子是_______(用离子符号表示)。
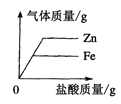
(2)金属与足量的酸反应存在各种规律,请你分析下表中的数据,找到对应关系:
lg金属与足量稀盐金属与足量(均生成+2价金属的盐溶液) | 镁 | 锌 | 铁 |
金属的相对原子质量 | 24 | 65 | 56 |
产生氢气的质量(g) | 2/24 | 2/65 | 2/56 |
你发现的规律 | _______ | ||
(拓展应用)
有两种外观类似黄金的①Cu-Zn合金和②Cu-Ag制品,若实验室只提供一瓶稀硫酸和必要仪器。
(3)你认为能测出合金________(填序号)中铜的质量分数;
(4)取上述(3)中所选合金粉末20g放人烧杯中,加人50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g,则:
①产生氢气的质量是________;
②该合金中铜的质量分数为_____________。
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是____,白色物质可能是(1)Na2O(2)碳酸钠
(3)___________________乙同学认为白色物质可能是氢氧化钠。甲同学立刻认为乙同学的猜想是错误的,其理由是_______________________________。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠: Na2O+H2O == 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | _______ | 白色物质 为氧化钠。 |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | _______ | 白色物质 是碳酸钠。 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | _______ |
【反思评价】丙同学认为方案1得到的结论不正确,其理由是_____________________。
【得出结论】钠在二氧化碳中燃烧的化学方程式为____________________________。由钠在二氧化碳中燃烧的实验还能得出什么结论?_________________(任意写一个)