题目内容
【题目】生石膏[化学式为CaSO4·2H2O]是一种用途广泛的工业材料和建筑材料。工业上用含SO2的烟气制备生石膏的简要流程图如下:

(1)在反应①时,常将NaOH溶液喷成雾状的原因是________。
(2)已知CaSO3不易溶于水,它属于________(填“酸”、“碱”、“盐”或“氧化物”),其中硫元素的化合价为______,反应②的化学方程式是_______。
(3)如果在实验室中进行分离操作a,所需的玻璃仪器有烧杯、玻璃棒和________。
(4)生产流程中生成的______可循环利用,节约成本。
【答案】 增大吸收面积,以加快反应速度 盐 +4 2CaSO3+O2=2CaSO4 漏斗 NaOH溶液
【解析】(1)在反应①时,常将NaOH溶液喷成雾状的原因是增大吸收面积,使反应物接触更充分,以加快反应速度,反应更彻底;(2) 由两种元素组成,且其中一种是氧的化合物叫氧化物。溶于水产生的阳离子只有氢离子的化合物是酸 。由金属或铵根和酸根组成的化合物叫盐,由金属或铵根和氢氧根组成的化合物叫碱。CaSO3属于盐,化合物中元素的化合价代数和为零,钙元素显+2价,氧元素显-2价,CaSO3中硫元素的化合价为+4,反应②的化学方程式是2CaSO3+O2=2CaSO4;(3)分离操作a是将难溶性固体与液体分离,操作是过滤,所需的玻璃仪器有烧杯、玻璃棒和漏斗;(4)生产流程中生成的NaOH溶液在反应物中存在,而且在后续的过程中又产生,可循环利用,节约成本。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】冰箱除味剂是利用活性炭制成的。某化学兴趣小组用冰箱除味剂进行了相关探究。
探究一:除味剂的还原性
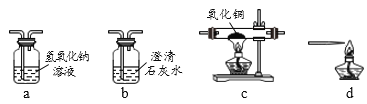
(1)除味剂与氧化铜粉末反应。实验前,小组同学将除味剂研磨成粉末的目的是_____。
(2)稳定的高温是本实验成功的关键因素之一,实验装置也会影响加热的效率。小组同学将如图的乙装置替代甲装置,将试管直立起来,并在酒精灯上加上网罩。实验时,将反应混合物夯实于试管底部,调节酒精灯使外焰完全包围试管的下部,其目的是提高加热温度,同学们展开充分的讨论,认为提高加热温度的方法还有_____ (答一种即可)。该反应的化学方程式为_____。
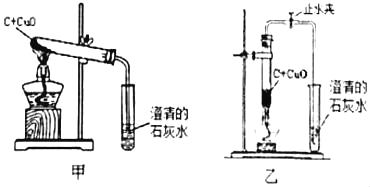
(3)他们在检验了乙装置的气密性后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时,_____(填“能”或“不能”)确定氧化铜和炭粉已经开始反应,其原因是_____。有同学认为此反应的生成物中一定有一氧化碳。生成一氧化碳的途径有可能_____。
A 碳和氧化铜反应不彻底生成
B 生成的二氧化碳和碳反应生成
C 试管里空气中本身含有一氧化碳
探究二:除味剂的吸附效果
小组同学认为除味剂的质量会影响吸附效果,设计了如下的实验,相关数据如表。
实验编号 | 10%红墨水溶液 | 同一规格除味剂 | 溶液褪色的时间 |
① | 10mL | 5g | 10min |
② | 10mL | 10g | 5min |
③ | 10mL | 12g | 4min |
④ | 10mL | 15g | 4min |
(4)上述实验的结论是_____。
(5)还有哪些因素可能会影响吸附效果?请说出你的猜想,并设计实验验证_____。
【题目】将一定量的丙醇(C3H8O)和氧气置于一个密封的容器中引燃,测得反应前后各物质的质量如表。下列说法错误的是( )
物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 14.8 | 0 | 0.4 | 0 |
反应后质量/g | 0 | 2 | 7.2 | 9.2 | a |
A. 表中a的值为2.8
B. 参加反应的氧气和生成二氧化碳的质量比为16:11
C. X中一定含碳元素、氧元素
D. 该反应属于分解反应