题目内容
【题目】质量守恒定律是化学反应遵循的普遍规律:
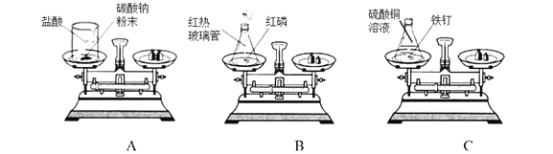
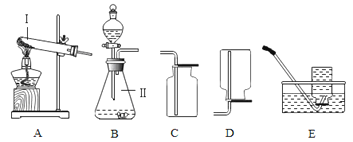
(1)上述实验方案中,不能用于验证质量守恒定律的是_________(填字母序号);
(2)B图中白磷能燃烧,是因为同时满足了燃烧所需的三个条件,请你简述____________,C图中发生反应的化学反应方程式为____________;
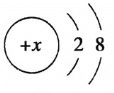
(3)一种焰火火药中所含的硝酸铜在燃烧时产生绿色火焰,发生的反应是: ![]() 根据质量守恒定律确定x的化学式为___________.
根据质量守恒定律确定x的化学式为___________.
(4)将一定质量的a、b、c、d四种物质放入一密闭的容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如表所示,根据质量守恒定律,下列说法中正确的是____(填序号).
物质 |
|
|
|
|
反应前质量(g) | 6 | 3 | 4 | 0.5 |
反应后质量(g) | 待测 | 2 | 6 | 0.5 |
A.反应后a物质的质量为5g
B.a和d是反应物,d一定是催化剂
C.物质中元素的种类一定等于a、b两种物质中元素种类之和
D.反应前后各元素的化合价可能不变
E.若物质a与b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为1:2
【答案】A 白磷是可燃物,与氧气接触,达到着火点 Fe+CuSO4═FeSO4+Cu NO2 ACDE
【解析】
(1)A方案中碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,生成的二氧化碳气体散逸到空气中去了,不能达到目的,故A错误;B方案中红磷在密闭的容器中反应,该方案进行验证质量守恒定律,能达到目的,故B正确;C方案中,铁与硫酸铜反应生成硫酸亚铁和铜,生成物和反应物中都没有气体产生也没有吸收空气中的气体,该方案进行验证质量守恒定律,能达到目的,故C正确。故选A;
(2)B图中白磷能燃烧,是因为同时满足了燃烧所需的三个条件,白磷是可燃物,与氧气接触,达到着火点;铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu;
(3)由反应的化学方程式可得知,反应物分子中含有的原子个数分别为:2个铜原子、4个氮原子、12个氧原子;生成物分子中已经含有的原子个数是:2个铜原子、4个氧原子,还缺少4个氮原子、8个氧原子, X前面系数是4,所以X中含有1个氮原子和2个氧原子,所以化学式是:NO2;
(4)A、根据质量守恒定律,由表中数据可知:a=6+3+4+0.5-2-6-0.5=5,故A正确;
B、a和b反应后质量减小,是反应物;c质量增加,是生成物;d质量不变,可能是催化剂,也有可能没有参加反应,故B错误;
C、a和b反应后质量减小,是反应物,c质量增加,是生成物,根据质量守恒定律可知,物质c中元素的种类一定等于a、b两种物质中元素种类之和,故C正确;
D、反应前后各元素的化合价可能不变,故D正确;
E、反应中物质a与b的质量之比=(6g-5g):(3g-2g)=1:1,若a与b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为=1:2,故E正确。故选ACDE。