题目内容
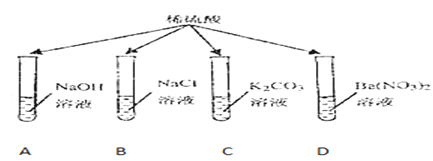
【题目】兴趣小组为探究某些酸碱盐之间能否发生反应,进行了如图所示的实验:把稀硫酸分别加入到盛有不同药品的A、B、C、D四只试管中。请回答:
(1)甲同学观察到A、B试管中均无明显现象,于是得出结论:硫酸与氢氧化钠及氯化钠都不能发生反应。乙同学认为A试管中发生了反应,理由是_____。(用化学方程式表示)。B试管中不能发生复分解反应,理由:_____。
(2)丙同学观察到C试管中有_____生成,于是得出结论:硫酸与碳酸钾能发生反应。
(3)丙同学对反应后C试管中溶液的溶质成分进行分析得出如下结论:
结论一:K2SO4 结论二:K2SO4、H2SO4 结论三:_____
丙同学设计实验,用两种方法验证结论三正确:
实验操作 | 实验现象 | 实验结论 |
方法一:取C中溶液少许,加入足量的BaCl2溶液 | 产生白色沉淀 | 结论三正确 |
方法二:取C中溶液少许,加入适量的_____ | 产生气泡 |
乙同学对方法一提出质疑,认为方法一不正确,理由是_____。
(4)丁同学观察到D试管中有白色沉淀生成,于是得出结论:硫酸与硝酸钡能发生反应。写出该反应的化学方程式_____。
【答案】 2NaOH+H2SO4=Na2SO4+2H2O; 硫酸与氯化钠交换成分后既没有气体,也没有沉淀或水生成 气体 K2SO4、K2CO3; 稀盐酸; 硫酸钾和硫酸也均能与氯化钡反应生成白色沉淀 H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
【解析】
本题考查了酸的化学性质和实验探究物质的组成成分等,解题时根据各种物质的性质,结合酸的通性,复分解反应发生的条件进行分析、判断得出正确的结论。
(1)硫酸与氢氧化钠发生中和反应生成硫酸钠和水,反应的化学方程式是:2NaOH+H2SO4=Na2SO4+2H2O;硫酸与氯化钠交换成分后既没有气体、也没有沉淀或水生成,不符合复分解反应的条件,不能发生复分解反应;
(2)碳酸钾与硫酸相互交换成分反应生成了硫酸钾、二氧化碳和水,可以观察到有气泡产生;
(3)因为碳酸钾与硫酸反应生成了硫酸钾、二氧化碳和水,二者恰好完全反应时,溶质是硫酸钾(K2SO4),若硫酸有剩余,则溶质是硫酸钾和硫酸(K2SO4、H2SO4),若碳酸钾有剩余,则溶质是碳酸钾和硫酸钾,所以结论三是K2SO4、K2CO3;因为硫酸钾是生成物,反应后的溶液中一定存在,若猜想三成立,则存在碳酸钾,碳酸钾与稀盐酸反应生成二氧化碳气体,证明碳酸钾的存在时,可加入适量的稀盐酸,若观察到产生气泡,证明结论三正确;硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,硫酸也能与氯化钡反应生成硫酸钡白色沉淀,不能确定溶液的成分是K2SO4、K2CO3,方法一不正确;
(4)硫酸与硝酸钡反应生成硫酸钡白色沉淀和硝酸;反应的化学方程式是:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3。