题目内容
【题目】实验室有一瓶存放时间过长的氢氧化钠,其中一部分已转化成为了碳酸钠。现
需用该药品配制氢氧化钠溶液。取50克该药品,溶于200mL水中(水的密度为1g/cm3),然后慢慢地滴加7.4%的澄清石灰水,当用去100克澄清石灰水时,碳酸钠恰好反应完全。
计算:(1)50克该药品中碳酸钠的质量;(2)滤出沉淀后所得溶液的溶质质量分数。(精确到0.01%)]
【答案】(共7分)
解:设50克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成CaCO3的质量为z。
Na2CO3+ Ca(OH)2=" " CaCO3↓ + 2NaOH
106 74 100 80
x 100×7.4% z y
x ="10.6 " y="8 " z ="10 " 2分
(1)50克该药品中碳酸钠的质量为10.6g 1分
(2)溶液中溶质NaOH的质量=" 8" +(50-10.6)= 47.4g(1分)
溶液的总质量 = 50+200+100-10=340g(1分)
反应后溶液中溶质的质量分数=![]() 100%==13.94%(1分)
100%==13.94%(1分)
答:50克该药品中碳酸钠的质量为10.6g,反应后生成的溶液中溶质的质量分数为13.94%(注:方程式书写正确解、设、答完整得1分)
【解析】
(1)根据氢氧化钙的质量,利用碳酸钠与氢氧化钙的反应求出碳酸钠的质量即可.
(2)溶液中氢氧化钠的质量等于原固体中氢氧化钠的质量与反应生成的氢氧化钠的质量之和,溶液的质量等于混合前的物质的总质量与生成沉淀的质量之差,利用这两个量可计算溶质的质量分数.
解:设50克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成CaCO3的质量为z。
Na2CO3+ Ca(OH)2= CaCO3↓ + 2NaOH
106 74 100 80
x 100×7.4% z y
x =10.6 y=8 z =10 ……………… 2分
(1)50克该药品中碳酸钠的质量为10.6g ………………1分
(2)溶液中溶质NaOH的质量=" 8" +(50-10.6)= 47.4g(1分)
溶液的总质量 = 50+200+100-10=340g(1分)
反应后溶液中溶质的质量分数=![]() 100%==13.94%(1分)
100%==13.94%(1分)
答:50克该药品中碳酸钠的质量为10.6g,反应后生成的溶液中溶质的质量分数为13.94%

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
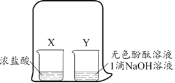
活力试卷系列答案【题目】兴趣小组为探究某些酸碱盐之间能否发生反应,进行了如图所示的实验:把稀硫酸分别加入到盛有不同药品的A、B、C、D四只试管中。请回答:
(1)甲同学观察到A、B试管中均无明显现象,于是得出结论:硫酸与氢氧化钠及氯化钠都不能发生反应。乙同学认为A试管中发生了反应,理由是_____。(用化学方程式表示)。B试管中不能发生复分解反应,理由:_____。
(2)丙同学观察到C试管中有_____生成,于是得出结论:硫酸与碳酸钾能发生反应。
(3)丙同学对反应后C试管中溶液的溶质成分进行分析得出如下结论:
结论一:K2SO4 结论二:K2SO4、H2SO4 结论三:_____
丙同学设计实验,用两种方法验证结论三正确:
实验操作 | 实验现象 | 实验结论 |
方法一:取C中溶液少许,加入足量的BaCl2溶液 | 产生白色沉淀 | 结论三正确 |
方法二:取C中溶液少许,加入适量的_____ | 产生气泡 |
乙同学对方法一提出质疑,认为方法一不正确,理由是_____。
(4)丁同学观察到D试管中有白色沉淀生成,于是得出结论:硫酸与硝酸钡能发生反应。写出该反应的化学方程式_____。
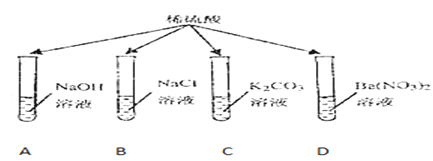
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
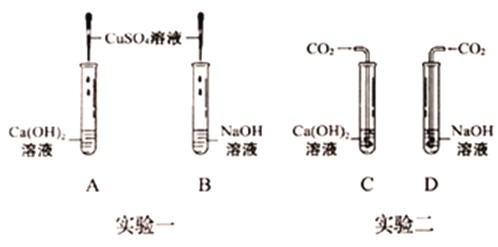
(1)实验一中,B试管中发生反应的化学方程式为_____。
A、B两支试管中共同的实验现象是_____。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是_____(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
(提出猜想)猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 | _____ | 猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
(反思与评价)I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是_____。
若要验证猜想2成立,需将Ca(OH)2溶液换成_____溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是_____(用文字叙述)
【题目】生活中可用柠檬酸除去水杯中的茶渍。柠檬酸是一种酸,它的化学式为C6H8O7,请从A或B两题中任选一个作答,若两题均作答,按A给分。

A | B |
(1)柠檬酸的相对分子质量的计算式为____________。 (2)柠檬酸溶液的pH________7(填“>”、“<”或“=”)。 | (1)柠檬酸中碳元素与氢元素的质量比为____________。 (2)向柠檬酸溶液中滴入紫色石蕊,溶液变为____________色。 |