题目内容
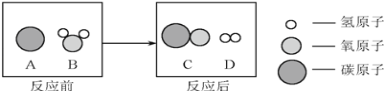
【题目】现探究一固体混合物的成分,已知其中可能含有Na2CO3、CuSO4、BaCl2、K2SO4、NaCl五种物质中的一种或几种,按图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)
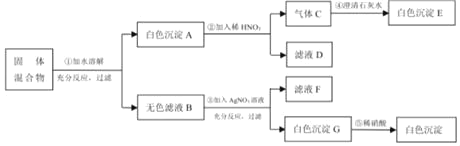
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)白色沉淀A的化学式为___。
(2)白色沉淀G的化学式为___。
(3)写出过程④中生成白色沉淀E的化学方程式___。
(4)固体混合物中,还不能确定存在的物质是___(写化学式)。
(5)滤液D中肯定大量存在的酸根离子为___(写离子符号)。
(6)固体混合物中一定不含有的物质是___(写化学式),得此结论的理由是___。
【答案】BaCO3 AgCl; CO2+Ca(OH)=CaCO3↓+H2O NaCl NO3- CuSO4、K2SO4 如果有硫酸铜,滤液B为蓝色,与题意不符;如果有硫酸钾,过程②白色沉淀A加稀硝酸后仍有白色沉淀,与题意不符。
【解析】
硫酸铜在溶液中显蓝色,碳酸根离子和钡离子反应生成溶于酸的碳酸钡沉淀,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,氯离子和银离子反应生成不溶于酸的氯化银沉淀,所以固体混合物加水溶解,得到的白色沉淀A中加入硝酸,生成气体C和滤液D,所以A中一定不含硫酸钡,样品中一定不含硫酸钠,一定含有氯化钡和碳酸钠,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以E是碳酸钙;无色滤液B中加入硝酸银会生成白色沉淀,所以G是氯化银沉淀,氯化钡会引入氯离子,所以样品中可能含能有氯化钠,一定不含硫酸铜
由分析可知:
(1)白色沉淀A的化学式为BaCO3;
(2)白色沉淀G的化学式为AgCl;
(3)过程④中生成白色沉淀E的反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式是:CO2+Ca(OH)=CaCO3↓+H2O;
(4)固体混合物中,还不能确定存在的物质是NaCl;
(5)滤液D中肯定大量存在的酸根离子为NO3-;
(6)固体混合物中一定不含有的物质是CuSO4、K2SO4,得此结论的理由是:如果有硫酸铜,滤液B为蓝色,与题意不符;如果有硫酸钾,过程②白色沉淀A加稀硝酸后仍有白色沉淀,与题意不符。

 导学全程练创优训练系列答案
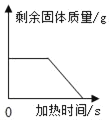
导学全程练创优训练系列答案【题目】铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行了以下实验:取出3g合金样品,将60g稀硫酸分为6等份依次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 | 第6份 |
剩余固体质量 | 2.5g | m | 1.5g | 1.0g | 0.6g | 0.6g |
(1)铜镁合金属于_____(填“混合物”或“纯净物“);
(2)加入稀硫酸发生反应的化学方程式为_____;
(3)分析数据可知表格中m=_____;
(4)合金样品中铜的质量分数是_____;
(5)若反应过程中产生的气体收集起来,可得到氢气的质量为多少g?_____