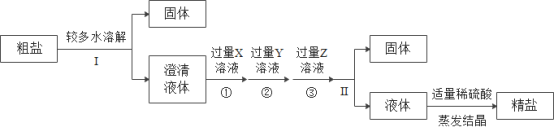
题目内容
【题目】下列A~H都是初中化学中常见的物质。已知A是沼气、可燃冰的重要成分,F可用于改良酸性土壤,它们之间的转化关系如下图所示。回答下列问题:
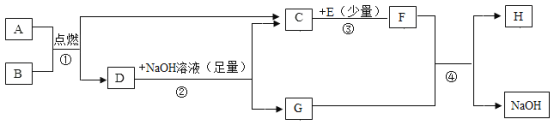
(1)A的化学式为____________,G俗称_____________。
(2)大气中D的含量过高会产生_________,从而导致全球气候变暖。
(3)反应③的化学方程式为___________,该反应过程能放出热量。
(4)反应④的化学方程式为________,其基本反应类型是复分解反应。
【答案】CH4 纯碱 温室效应增强 ![]()
![]()
【解析】
A是沼气、可燃冰的重要成分,则A是甲烷;F可用于改良酸性土壤,则F是氢氧化钙;根据转化关系,则B是氧气;D可与氢氧化钠溶液反应生成碳酸钠和水,则D为二氧化碳,那么C是水、G是碳酸钠;C和E反应生成氢氧化钙,则E是氧化钙;碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,则H是碳酸钙,代入验证,符合推导。
(1)A是甲烷,化学式为CH4,G是碳酸钠,俗称纯碱。
(2)大气中二氧化碳的含量过高会产生温室效应增强,从而导致全球气候变暖。
(3)反应③是氧化钙和水反应生成氢氧化钙,其化学方程式为![]() 。
。
(4)反应④是碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,其化学方程式为![]() 。
。

练习册系列答案
相关题目