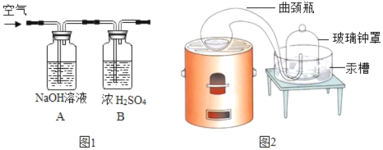
题目内容
【题目】某白色固体可能含有Na2CO3、Na2SO4、NaOH、Ba(NO3)2中的一种或几种.进行如下实验:(已知氯化钡溶液呈中性)
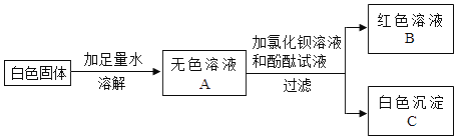
(1)在白色沉淀C中加入________,有气泡产生,沉淀全部溶解.根据上述实验分析,原白色固体中一定有________,一定没有________。
(2)为进一步确定白色固体中可能存在的物质,对红色溶液B进行实验,完成下表.
实验操作 | 实验现象 | 分析与结论 |
取少量红色溶液于试管中,加入 ________(限用一种试剂) | ________ | 原白色中固体有氢氧化钠 |
【答案】盐酸 Na2CO3 Na2SO4、Ba(NO3)2 氯化钙溶液 溶液呈红色
【解析】
根据“在白色沉淀C中加入 盐酸,有气泡产生,沉淀全部溶解“,说明为碳酸钡沉淀,一定无硫酸钡沉淀。故原白色固体中一定有 Na2CO3,一定没有 Na2SO4、Ba(NO3)2,因为白色固体溶于水,为无色溶液;考虑碳酸钠溶液为碱性,故必须先除掉碳酸钠,再验证是否有氢氧化钠。
(1)在白色沉淀C中加入盐酸,有气泡产生,沉淀全部溶解。根据上述实验分析,原白色固体中一定有Na2CO3,一定没有Na2SO4、Ba(NO3)2;
(2)添加的氯化钡溶液非过量,所以红色溶液B中可能含有未反应完的碳酸钠和原物质氢氧化钠,为进一步确定白色固体中可能存在的物质,对红色溶液B进行实验,如下:取少量红色溶液于试管中,加入足量氯化钙溶液;溶液呈红色;所以原白色中固体有氢氧化钠。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目