题目内容
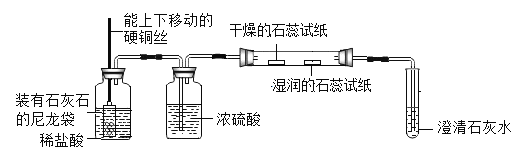
【题目】溶洞都分布在石灰岩组成的山洞中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2。某化学兴趣小组同学们思考:若向碳酸钠溶液中通入一定量二氧化碳,是否能生成碳酸氢钠(NaHCO3)?于是他们开始实验探究。(不考虑二氧化碳和碳酸作为溶质的情况)
(提出问题)
所得溶液中所含溶质成分是什么?
(查阅资料)
(1)碳酸氢盐[如Ca(HCO3)2、Ba(HCO3)2、NaHCO3]都能溶于水
(2)Na2CO3、NaHCO3的溶液呈碱性、BaCl2溶液呈中性
(提出猜想)
猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为_____。
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
(1)取反应后溶液少许于试管中,滴加几滴_____试液; | 溶液变红色 | 该溶液显碱性 |
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液; | 有白色沉淀生成 | 猜想_____不成立 |
(3)_____ | _____ | 猜想三成立 |
(得出结论)猜想三成立,证明二氧化碳通入碳酸钠溶液生成了碳酸氢钠。
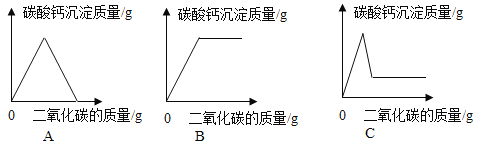
(拓展应用)同学们回忆实验室用澄清石灰水检验二氧化碳的情景,结合上述知识,如果向一定量的澄清石灰水中不断通入二氧化碳气体,下列哪一个图像能正确反映生成的碳酸钙沉淀与二氧化碳的质量之间的变化关系_____(填字母序号)。
【答案】Na2CO3和NaHCO3 酚酞 二 取适量实验步骤(2)中反应后试管中的上层清液,滴加稀盐酸 产生气泡 A
【解析】
[提出猜想]
根据题中提供的信息,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙。碳酸钠和碳酸钙一样也是碳酸盐,向碳酸钠溶液中通入一定量二氧化碳,也能生成碳酸氢钠。因此向碳酸钠溶液中通入一定量二氧化碳后得到的溶液中溶质可能是:碳酸钠没有反应、部分反应或全部反应。具体情况为:
猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为Na2CO3和NaHCO3。
[实验验证]
(1)实验现象:溶液变红色,实验结论:该溶液显碱性。遇碱性溶液变红的指示剂是无色酚酞溶液,因此该实验步骤中向反应后溶液中滴加的是无色酚酞溶液;
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液;实验现象是:有白色沉淀生成。根据题中提供的信息,碳酸氢盐[如Ca(HCO3)2、Ba(HCO3)2、NaHCO3]都能溶于水,实验中有白色沉淀生成,则溶液中一定有碳酸钠,因为碳酸钠和BaCl2溶液反应能生成碳酸钡沉淀,故猜想二不成立;
(3)实验(3)的结论是猜想三成立。因为实验(2)已经证明溶液中含有碳酸钠,所以只要证明溶液中还含有NaHCO3就行,而实验(2)中加入过量的BaCl2溶液后,溶液中碳酸钠已经被除尽,且氯化钡溶液呈中性,因此实验(3)的步骤是:取适量实验步骤(2)中反应后试管中的上层清液,滴加稀盐酸;因为碳酸氢钠和稀盐酸反应产生二氧化碳气体,所以该实验的现象是:产生气泡。
[拓展应用]
如果向一定量的澄清石灰水中不断通入二氧化碳气体,应该是首先发生二氧化碳和氢氧化钙溶液的反应,反应中生成碳酸钙沉淀,随着二氧化碳的增加沉淀质量不断增加,氢氧化钙反应完时生成的碳酸钙质量达到最大值;如果继续通入二氧化碳,碳酸钙沉淀就会和二氧化碳及水反应生成能溶于水的Ca(HCO3)2,沉淀质量就不断减小,直至为0。故能正确反映生成的碳酸钙沉淀与二氧化碳的质量之间的变化关系的图像是:A。图像B中碳酸钙质量达到最大值后,继续通入二氧化碳,碳酸钙质量不变,应该逐渐减少直至为0,关系不正确;图像C中碳酸钙质量减少到一定数值后,不再变化,应该最后为0,关系不正确。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案