题目内容
【题目】小明在协助老师清理实验储备室时,发现一瓶存放多年的氢氧化钙,为检验其变质情况,进行如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,然后逐滴滴加14.6%的稀盐酸,加入稀盐酸的质量与锥形瓶中物质的质量关系如下表所示,请问:
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
锥形瓶中物质的质量/g | 60 | 70 | 80 | 90 | 100 | 109.12 | 118.24 | 128.24 |
(1)氢氧化钙变质的原因是 (用化学方程式表示)。
(2)与氢氧化钙反应的稀盐酸溶液的质量为 g。
(3)计算11.4g该样品中氢氧化钙的质量分数(写出计算过程,结果精确到0.1%)。
(4)根据计算所得数据画出生成CO2的质量的曲线。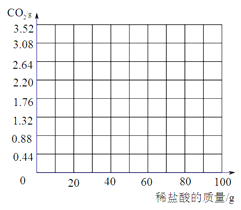
【答案】(1)Ca(OH)2+CO2=CaCO3↓+H2O;(2)50;(3)64.9%;(4)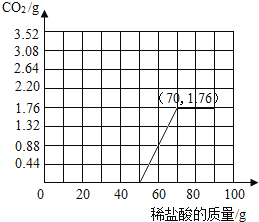
【解析】(1)氢氧化钙属于碱,易与空气中CO2反应生成碳酸钙和水,其变质时发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;
(2)在添加稀盐酸50g~60g时生成CO2的质量为60g+50g-109.12g=0.88g;在添加稀盐酸60g~70g时生成CO2的质量为70g+50g-118.24g=1.76g;在此基础上继续滴加稀盐酸,无CO2生成,则说明与碳酸钙反应的稀盐酸是20g,与氢氧化钙反应的稀盐酸溶液的质量为50g;
(3)设10g稀盐酸中HCl的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x 0.88g
![]() =
=![]() ,解得:x=1.46g,
,解得:x=1.46g,
设11.4g样品中氢氧化钙的质量为y,
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
y 1.46g×50
![]() =
=![]() ,解得:y=7.4g;
,解得:y=7.4g;
11.4g该样品中氢氧化钙的质量分数为![]() ×100%=64.9%。
×100%=64.9%。
(4)由图表可知,滴加50g稀盐酸后继续滴加有CO2生成,滴加稀盐酸至70g时CO2生成量为1.76g,继续滴加无CO2生成,所得图表为: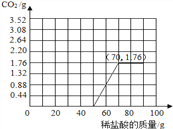 。
。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】某兴趣小组同学对NaOH、Na2CO3、NaHCO3、NaCl等常见的钠的化合物进行了研究。
【知识回顾】下列相关说法正确的是___。
A.NaCl主要存在于海水中
B.烧碱(NaOH)和纯碱(Na2CO3)都属于碱
C.Na2CO3和NaHCO3的俗名分别为苏打和小苏打
D.NaOH和Na2CO3都可用于治疗胃酸过多
【分析判断】电解饱和食盐水可制得“84”消毒液。你认为“84”消毒液的有效成分可能是__。
A.SO2 B. Na2CO3 C.KMnO4 D.NaClO
【提出问题】NaOH露置于空气中易变质,那么实验室中的氢氧化钠有没有变质呢?该小组同学对实验室中一瓶氢氧化钠固体样品的成分进行了探究。
【查阅资料】①NaOH在空气中不会转化成NaHCO3。
②BaCl2溶液呈中性,Ba(OH)2是可溶性碱。
③CO2在饱和的NaHCO3溶液中几乎不溶解。
【提出猜想】猜想Ⅰ:样品中只有NaOH
猜想Ⅱ:样品中只有Na2CO3
猜想Ⅲ:样品中既有NaOH又有Na2CO3
【实验探究】兴趣小组同学设计如下实验进行探究。
实验操作 | 实验现象与结论 |
1.取少量样品,加足量水。 | 样品全部溶解,得无色溶液。 |
2.取少量实验1所得无色溶液于试管中,滴加足量稀盐酸。 | 有气泡产生,则猜想_______(填“Ⅰ”、“Ⅱ”或“Ⅲ”)不成立。 |
3.取少量实验1所得无色溶液于试管中, 滴加足量BaCl2溶液。 | 有白色沉淀产生,有关化学方程式为_____________。 |
4.实验操作:__________________。 | 对应现象:______________,则猜想Ⅲ成立。 |
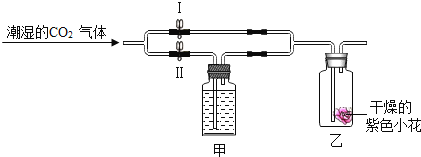
【定量研究】上述样品变质的程度如何呢?该兴趣小组同学设计如下图 装置测定样品中Na2CO3的质量分数。
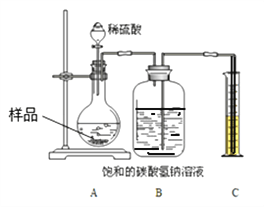
步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开分液漏斗活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL。(已知:室温条件下,CO2的密度为1.6gL﹣1)
(1)B装置集气瓶内原有的空气对实验结果_______________(填“有”或“没有”)影响。若用水代替饱和NaHCO3溶液,则所测CO2体积会偏小,原因是___________
(2)若将分液漏斗中的稀硫酸换成稀盐酸,则测试的结果可能______(填“偏大”、“偏小”或“不变”)。
(3)计算该样品中Na2CO3的质量分数((写出计算过程,结果保留到0.1%)__________。