��Ŀ����
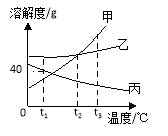
����Ŀ����ͼ��Ԫ�����ڱ���1��3���ڵ�ԭ�ӽṹ��ͼ��37��Ԫ��﨣�Ԫ�ط���ΪRb����ԭ�ӽṹ��ͼ��
��1���ڵڶ������У���Ԫ��ԭ�ӽṹ�Ĺ�ͬ����______________��
��2���ڶ����������У���Ԫ��ԭ�������������ı仯������________________________��
��3����1�š�8�š�11��Ԫ����ɵĻ�����X����1�š�17��Ԫ����ɵĻ�����Y��X��Y��ˮ��Һ�ᷢ����ѧ��Ӧ���仯ѧ��Ӧ����ʽΪ______________________________��
��4�����Ԫ�����ڱ���λ�ڵ�_____���ڣ�д��卑�������Ļ�ѧʽ__________��
���𰸡� ���Ӳ�������2 ������ԭ�������������������ε��������1��8������ NaOH+HCl=NaCl+H2O 5 Rb2O
��������(1)ͬһ���ڵ�Ԫ������Ӳ���һ����ͬ���ڶ�����Ԫ�ص��Ӳ��Ƕ���2�㣻
(2)�۲���еڶ��������ڸ�Ԫ�������������ı仯���Կ���������������������1������8��
(3)1��Ԫ������Ԫ�أ�8��Ԫ������Ԫ�أ�11��Ԫ������Ԫ�أ�����Ԫ����ɵĻ��������������ƣ�17��Ԫ������Ԫ�أ�����Ԫ����ɵĻ��������Ȼ��⣬��ˮ��Һ�����ᣬ�������������Ʒ����кͷ�Ӧ�����Ȼ��ƺ�ˮ���䷴Ӧ����ʽΪNaOH+HCl=NaCl+H2O��
(4)���ݵ��Ӳ���������������卑ĺ�����5�����Ӳ����Ԫ�����ڱ���λ�ڵ�5���ڣ�卑�������������1���ʻ��ϼ�Ϊ+1�ۣ����Ļ��ϼ�Ϊ-2�ۣ���卑�������Ļ�ѧʽRb2O��

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д�����Ŀ��ij��ȤС��ͬѧ��NaOH��Na2CO3��NaHCO3��NaCl�ȳ������ƵĻ�����������о���
��֪ʶ�عˡ��������˵����ȷ����___��
����NaCl��Ҫ�����ں�ˮ��
�£��ռNaOH���ʹ��Na2CO3�������ڼ�
�ã�Na2CO3��NaHCO3�������ֱ�Ϊ�մ��С�մ�
�ģ�NaOH��Na2CO3������������θ�����
�������жϡ���ⱥ��ʳ��ˮ���Ƶá�84������Һ������Ϊ��84������Һ����Ч�ɷֿ�����__��
A��SO2 B�� Na2CO3 C��KMnO4 D��NaClO
��������⡿NaOH¶���ڿ������ױ��ʣ���ôʵ�����е�����������û�б����أ���С��ͬѧ��ʵ������һƿ�������ƹ�����Ʒ�ijɷֽ�����̽����
���������ϡ���NaOH�ڿ����в���ת����NaHCO3��
��BaCl2��Һ�����ԣ�Ba(OH)2�ǿ����Լ
��CO2�ڱ��͵�NaHCO3��Һ�м������ܽ⡣
��������롿�������Ʒ��ֻ��NaOH
�������Ʒ��ֻ��Na2CO3
�������Ʒ�м���NaOH����Na2CO3
��ʵ��̽������ȤС��ͬѧ�������ʵ�����̽����
ʵ����� | ʵ����������� |
1��ȡ������Ʒ��������ˮ�� | ��Ʒȫ���ܽ⣬����ɫ��Һ�� |
2��ȡ����ʵ��1������ɫ��Һ���Թ��У��μ�����ϡ���ᡣ | �����ݲ����������_______����������������� |
3��ȡ����ʵ��1������ɫ��Һ���Թ��У� �μ�����BaCl2��Һ�� | �а�ɫ�����������йػ�ѧ����ʽΪ_____________�� |
4.ʵ�������__________________�� | ��Ӧ����______________������������� |
�������о���������Ʒ���ʵij̶�����أ�����ȤС��ͬѧ�������ͼ װ�òⶨ��Ʒ��Na2CO3������������
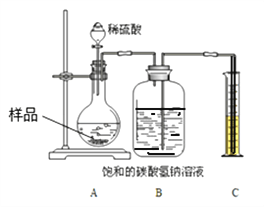
�������£��ٰ�ͼ���Ӻ�װ�ã�����������ԣ���ȷ��ȡ����Ʒ1.0g��������ƿ�ڣ��۴�Һ©���������μ�30.0%��ϡ�������������رջ������ܷ�Ӧ��������Ͳ��Һ��Ķ���Ϊ55.0mL������֪�����������£�CO2���ܶ�Ϊ1.6gL��1��
��1��Bװ�ü���ƿ��ԭ�еĿ�����ʵ����_______________����С���û�С���Ӱ�졣����ˮ���汥��NaHCO3��Һ��������CO2�����ƫС��ԭ����___________
��2��������Һ©���е�ϡ���ỻ��ϡ���ᣬ����ԵĽ������______���ƫ����ƫС�����䡱����
��3���������Ʒ��Na2CO3��������������д��������̣��������������������__________��
����Ŀ��ij������ȤС���һ������Ʒ(���ʲ�����ˮҲ����ϡ���ᷴӦ)���з������ס��ҡ�����λͬѧ�ֱ����ʵ�飬����ֻ��һλͬѧ��ȡ�õ�ϡ����������Ʒǡ����ȫ��Ӧ��ʵ���������±���ʾ����������������ݣ��ش��������⣺
�� | �� | �� | |
��Ӧǰ���ձ�+ϡ���� | 200g | 150g | 150g |
���������Ʒ���� | 10g | 10g | 14g |
��ַ�Ӧ���ձ�+ʣ���� | 209.8g | 159.8g | 163.8g |
��1��ͬѧ��ȡ�õ�ϡ����������Ʒ ǡ����ȫ��Ӧ��
��2��������Ʒ����������������
��3������ǡ����ȫ��Ӧ��������Һ�����ʵ�����������(�ձ�������Ϊ25 g����������ȷ��0.1%)