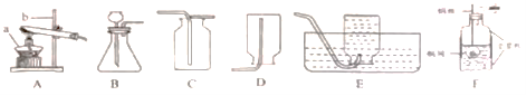题目内容
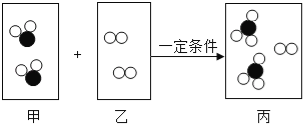
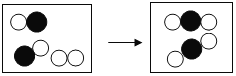
【题目】下图是某化学反应的微观模拟示意图,每个小球代表一种元素的原子。下列说法正确的是
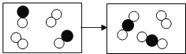
A. 该反应前后元素的种类发生了改变
B. 化学反应中,反应物、生成物的微粒个数比为2:2:2:1
C. 该图示说明化学变化中分子、原子都可分
D. 该反应是一个化合反应
【答案】D
【解析】
解:由化学反应的微观模拟示意图可知,各物质反应的微粒个数关系是:
 ;
;
A、由质量守恒定律可知,化学反应前后元素的种类不变,故错误;
B、由化学反应的微观模拟示意图可知,化学反应中,反应物、生成物的微粒个数比为2:1:2的关系,故错误;
C、原子是化学变化中的最小粒子,所以在化学反应前后原子的种类不变,故错误;
D、由微观反应示意图可知,反应物是两种,生成物是一种,符合“多变一”的特征,属于化合反应,故正确。
故选D。

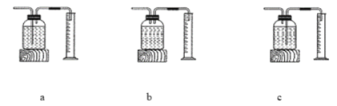
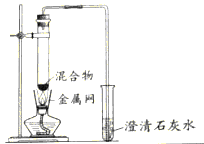
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1—1 | 1—2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1—2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2—1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2—2 | 1:10 | 混有很少量黑色物质 | |
2—3 | 1:11 | 混有极少量黑色物质 | |
2—4 | 1:12 | 无黑色物质 | |
2—5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)配平化学方程式:□C+□CuO高温 □Cu+ □CO2↑______,这个反应中CuO是______剂。
(2)实验1—2中,证明此产生了CO2的现象是__________,写出化学方程式______________
(3)实验1的目的是___________。
(4)实验2的结论是:木炭与氧化铜反应的最佳质量比为_______。
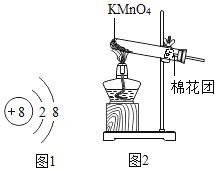
【题目】某兴趣小组同学对实验室制氧气的条件进行如下探究:
(a)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
①将3.0g氯酸钾和1.0g二氧化锰均匀混合加热;
②将xg氯酸钾和1.0g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
①中反应的化学方程式是__________________________;②中x的值应为_____。
(猜想)除二氧化锰,氧化铜外,Fe2O3也可以做氯酸钾分解的催化剂。
按下表进行实验:测定分解温度(分解温度越低,催化效果越好)
实验编号 | 实验药品 | 分解温度/℃ |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1∶1) | 350 |
③ | 氯酸钾、氧化铜(质量比1∶1) | 370 |
④ | 氯酸钾、Fe2O3(质量比1∶1) | 390 |
由实验________与实验④对比,证明猜想合理。实验所用的三种金属氧化物,催化效果最好的是___。
(b)乙探究了影响过氧化氢溶液分解速率的某种因素。实验记录如下:
过氧化氢溶液的质量 | 过氧化氢的浓度 | 二氧化锰的质量 | 相同时间内产生VO2 | |
① | 50.0g | 1% | 0.1g | 9mL |
② | 50.0g | 2% | 0.1g | 16mL |
③ | 50.0g | 4% | 0.1g | 31mL |
实验结论:在相同条件下,_______________________________,过氧化氢分解得越快。本实验中测量O2体积的装置(如图)应该选择:_______。(填字母)