题目内容
【题目】“五·一”小长假后,小刚和小敏带着快乐的心情返回学校。当他们来到实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钠固体,由此,激发了他们的探究欲望。
【提出问题】这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中变质的原因是 (用化学方程式表示)。
【提出猜想】猜想一:没有变质;
猜想二:部分变质;
猜想三:全部变质。
【实验探究】小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质。
小敏认为小刚的结论是错误的,理由是 。
于是小敏进行了如下实验:

(1)上述实验操作④的名称 ,其中玻璃棒的作用 。
(2)步骤③中加过量氯化钙溶液的目的是 。
(3)步骤⑤中,小敏用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,
他判断猜想二是正确的。对他的操作方法、测量结果及结论的评价,正确的是 。
A.方法正确,结果正确,且结论正确
B.方法正确,结果正确,结论不正确
C.方法不正确,结果偏大,但结论正确
D.方法不正确,结果偏小,但结论正确
【交流反思】
(1)在实验室里氢氧化钠需要密封保存。药品密封保存的原因很多,请你写出浓硫酸需要
密封保存的原因 。
(2)下列物质能替代小敏实验中CaCl2溶液的是 (填序号)。
①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2 溶液。
【答案】【提出问题】CO2 +2NaOH = Na2CO3 + H2O
【实验探究】若变质,则生成的Na2CO3其溶液也呈碱性
(1)过滤 引流 (2)使Na2CO3完全反应,排除干扰(或证明并完全除去Na2CO3) (3)D
【交流反思】(1)浓硫酸有很强的吸水性 (2)①②
【解析】
试题分析:氢氧化钠能与空气的二氧化碳反应生成碳酸钠而变质,由于碳酸钠溶液也呈碱性,故不能用酚酞来判断溶液是否变质;
要分离固体和液体,采用过滤的方法,过滤时玻璃棒起引流的作用;
若有碳酸钠,氯化钙会与碳酸钠反应生成碳酸钙沉淀和氯化钠,由于氯化钙溶液呈中性,生成的氯化钠也呈中性,故可根据溶液的PH来判断溶液中是否有氢氧化钠;
用湿润的pH试纸,相当于稀释了溶液导致碱性减弱,测定的PH偏小;
【交流反思】浓硫酸具有吸水性,若敞口放置在空气中溶质质量分数会减小;氯化钙溶液呈中性,只有①②溶液也呈中性,③④溶液呈碱性,会影响实验结果。

【题目】(6分)根据下面的溶解度表与溶解度曲线,回答下列问题:

温度/°C 溶解度/g | 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
(1)氯化钠溶液中的溶剂是 。
(2)20℃时,NaCl的溶解度是 g。
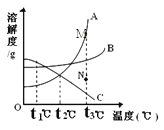
(3)图中能表示KNO3溶解度曲线的是 (填“A”或“B”)。
(4)20℃时,将40g KNO3放入盛有100g水的烧杯中,充分溶解,得到硝酸钾溶液的质量为 g,继续加热至80℃,下列各量一定变大的是 (填字母序号)。
A.溶质质量 B.溶剂质量 C.溶解度 D.溶质的质量分数
(5)实验室配制500g 10%氯化钠溶液需要氯化钠固体质量 g。