题目内容
【题目】小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
实验序号 |
| 其他物质质量 | 待测数据 |
① |
| / | |
② |
|
| |
③ |
|
|
(1)上述实验应测量的“待测数据”是________.
(2)若实验②比实验①的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
(评价设计)你认为小雨设计实验③和实验②对比的目的是________.
【答案】收集等量氧气所需时间 小 探究氧化铜和二氧化锰哪一个催化效果好
【解析】
由题意探究实验的目的是为了证明氧化铜能加快氯酸钾的分解,若氧化铜能加快氯酸钾的分解速率,实验②比实验①所用时间小,还需要一个对比的标准,这个标准可以是收集等量氧气所需要的时间或者相同时间收集氧气的体积;实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好,则有:
(1)本题的实验目的证明氧化铜能加快氯酸钾的分解,所以“待测数据”是收集等量氧气所需时间或相同时间收集氧气的体积。
(2)如果氧化铜能加快氯酸钾的分解速率,实验②比实验①所用时间小。
评价设计:
实验③和实验②对比的目的是探究氧化铜和二氧化锰哪一个催化效果好。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
初步探究:探究影响过氧化氢分解速率的因素
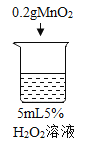
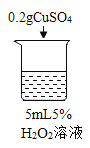
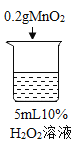
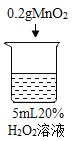
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰
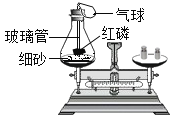
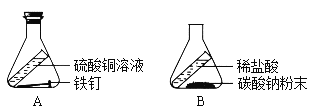
【题目】质量守恒定律能够用实验验证:(从A或B中任选一个作答。)
A | B |
|
|
用上述实验,验证质量守恒定律(实验前后利用天平称量质量)。 实验过程中气球的变化为_____;充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因:_____。 | 某兴趣小组同学利用上述实验,验证质量守恒定律(实验前后利用天平称量质量)。 A、B实验中,不能验证质量守恒定律的有_____,原因是_____。 |