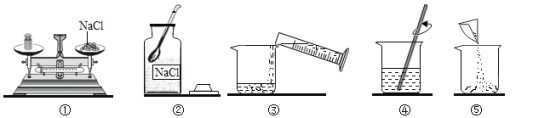
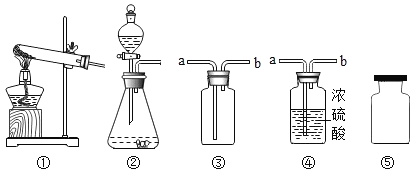
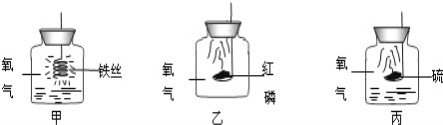
题目内容
【题目】乙硫醇(化学式为 C2H6S)易挥发,有蒜臭味,人对该气体极其敏感,下列有关乙硫醇的说法不正确的是( )
A.乙硫醇的相对分子质量为 62
B.乙硫醇中 C、H、S 三种元素的质量比为 2:6:1
C.硫元素的质量分数是![]() ×100%
×100%
D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
【答案】B
【解析】
试题分析:A 项,乙硫醇的相对分子质量为:12×2+1×6+32=62,正确;B 项,2:6:1 为乙硫醇中 C、H、S 的原子个数比,这三种元素的质量比应为 12:3:16,故 B 错;C 项,乙硫醇中硫元素的质量分数是![]() ×100%,正确;D 项,乙硫醇有蒜臭味,人对该气体极其敏感,可以通过闻该气体气味来判断煤气是否泄漏,正确。
×100%,正确;D 项,乙硫醇有蒜臭味,人对该气体极其敏感,可以通过闻该气体气味来判断煤气是否泄漏,正确。

 寒假乐园北京教育出版社系列答案
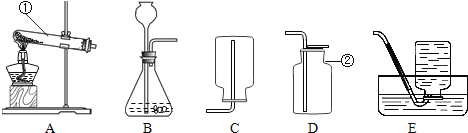
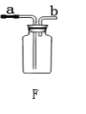
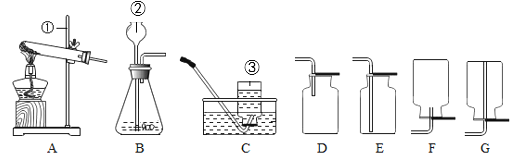
寒假乐园北京教育出版社系列答案【题目】小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V。 (实验中操作正确,O2的密度为ρg/cm3)
实验序号 | 1 | 2 | 3 |
m1(MnO2)/g | |||
m2(KClO3)/g | |||
m3(试管)/g | |||
m4(试管+加热后剩余固体)/g | |||
量筒内收集气体的体积V/cm3 |

(1)实验前应检查装置的__________,二氧化锰在该反应中的作用是________.
(2)根据质量守恒定律,m1、m2、m3、m4与V和ρ之间应存在的等量关系为_________。
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的MnO2分离并测量其质量,发现总小于加热前MnO2的质量。查阅资料后发现,一般认为加热KC103和MnO2混合物的反应过程如下:(请补全第2步的化学方程式)
第1步:2MnO2+2KClO3![]() 2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第2步:__________;
第3步:K2MnO4+Cl2![]() 2KCl+MnO2+O2↑
2KCl+MnO2+O2↑
根据反应过程分析,加热后剩余固体中MnO2质量总小于加热前MnO2质量的原因是:______。