题目内容
【题目】二百多年前,法国化学家拉瓦锡用图1装置定量的研究了空气的成分。仿照这个历史上著名实验的原理,用图2所示装置来测定空气中氧气的含量。

(实验回顾)图2是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。写出红磷燃烧的符号表达式_____。
(分析讨论)用红磷燃烧的方法测出的氧气含量总是低于21%,有没有其他物质可以代替红磷进行实验而使实验结果更准确呢?
(实验改进1)同学们用蜡烛代替红磷测定空气中氧气的含量,发现蜡烛很快熄灭,回流到集气瓶中的水远远小于瓶中气体体积的1/5。是什么原因所致呢?
(猜想与假设)猜想①:蜡烛燃烧产生CO2气体;猜想②:_____。
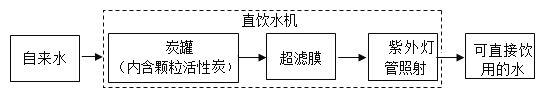
(实验验证)将蜡烛点燃后用氧气传感器定量测定瓶中的氧气含量,数据如图3。
(得出结论)空气中氧气体积分数降低了_____%。
(查阅资料)在老师的指导下,同学们查阅了红磷、白磷、蜡烛等可燃物燃烧所需要的最低含氧量以及其他信息如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用过量红磷、白磷、蜡烛进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:二氧化碳因与氢氧化钠溶液发生化学反应,实验室常用氢氧化钠溶液来吸收二氧化碳。
资料3:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度不断变小的同时,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与氢氧化钠溶液反应。
(交流与讨论)根据以上信息回答下列问题:
①白磷和红磷相比,使用白磷能使结果更准确,其原因是_____。
②有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量氢氧化钠溶液吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是_____。
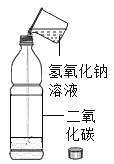
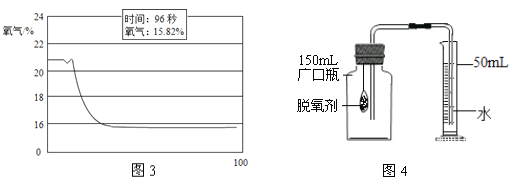
(实验改进2)食品脱氧剂(以铁粉为主的物质组成)能通过化学反应除去密闭包装袋中的氧气,使食品处于无氧状态。同学们尝试用图4装置进行实验来测定空气中氧气的含量。
下表是实验过程中记录的有关数据:
实验所需的时间/min | 0 | 5 | 10 | 30 | 35 | 45 |
量筒中液面的刻度/mL | 50 | 35 | 27.5 | 19.7 | 19.7 | 19.7 |
①脱氧剂发生复杂的化学反应,首先是铁粉与氧气、水反应生成氢氧化亚铁固体,写出该反应的符号表达式_____。
<>②分析表中数据得知,至少经过_____分钟后,量筒中的液面不再下降。③根据表中实验数据进行推算,广口瓶中氧气的体积分数约为_____(结果精确到0.1%)。
(实验拓展)铁在不同的条件下与氧气反应可生成不同种铁的氧化物, 58g四氧化三铁与多少克氧化铁(Fe2O3)中所含铁元素质量相等?_____(写出计算过程)
(实验评价)与燃烧红磷法相比,用脱氧剂测定空气中氧气含量的优点是_____。
【答案】P+O2![]() P2O5 装置漏气(合理均可) 5.18 白磷消耗氧气更彻底 木炭在氧气浓度较低时会生成一氧化碳气体,一氧化碳难溶于水且不与氢氧化钠溶液反应 铁+氧气+水
P2O5 装置漏气(合理均可) 5.18 白磷消耗氧气更彻底 木炭在氧气浓度较低时会生成一氧化碳气体,一氧化碳难溶于水且不与氢氧化钠溶液反应 铁+氧气+水![]() 氢氧化亚铁 30 20.2% 60g(过程见解析) 氧气消耗更彻底,装置始终密闭,减少了误差,使测定结果更准确
氢氧化亚铁 30 20.2% 60g(过程见解析) 氧气消耗更彻底,装置始终密闭,减少了误差,使测定结果更准确
【解析】
[实验回顾]
红磷燃烧生成五氧化二磷,反应的符号表达式为:P+O2![]() P2O5。
P2O5。
故填:P+O2![]() P2O5。
P2O5。
[猜想与假设]
猜想①:蜡烛燃烧产生CO2气体;猜想②:装置漏气等。
故填:装置漏气(合理均可)。
[得出结论]
空气中氧气体积分数降低了:21%-15.82%=5.18%。
故填:5.18。
[交流与讨论]
①白磷和红磷相比,使用白磷能使结果更准确,其原因是白磷消耗氧气更彻底。
故填:白磷消耗氧气更彻底。
②小华觉得不可行,其主要原因是木炭在氧气浓度较低时会生成一氧化碳气体,一氧化碳难溶于水且不与氢氧化钠溶液反应。
故填:木炭在氧气浓度较低时会生成一氧化碳气体,一氧化碳难溶于水且不与氢氧化钠溶液反应。
[实验改进2]
①脱氧剂发生复杂的化学反应,首先是铁粉与氧气、水反应生成氢氧化亚铁固体,该反应的文字表达式为:铁+氧气+水![]() 氢氧化亚铁。
氢氧化亚铁。
故填:铁+氧气+水![]() 氢氧化亚铁。
氢氧化亚铁。
②分析表中数据得知,至少经过30分钟后,量筒中的液面不再下降。
故填:30。
③根据表中实验数据进行推算,广口瓶中氧气的体积分数约为:
![]() ;
;
故填:20.2%。
[实验拓展]
设58g四氧化三铁与质量为x的氧化铁(Fe2O3)中所含铁元素质量相等,
根据题意有:![]() ,解得x=60g,
,解得x=60g,
答:58g四氧化三铁与60g氧化铁(Fe2O3)中所含铁元素质量相等。
[实验评价]
与燃烧红磷法相比,用脱氧剂测定空气中氧气含量的优点是:氧气消耗更彻底,装置始终密闭,减少了误差,使测定结果更准确。
故填:氧气消耗更彻底,装置始终密闭,减少了误差,使测定结果更准确。

【题目】实验室配制50g质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足量的硝酸钾固体和水,请选用上述药品设计三种配制方案,并填入下表:
配制方案(只要说明配制所需的各种药品及用量即可) | |
方案一 |
|
方案二 |
|
方案三 |
|
【题目】文文想通过实验测定稀硫酸中硫酸的质量分数,他分四次向182.5g稀硫酸(包含硫酸和水)中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如图。
次数 | 1 | 2 | 3 | 4 |
锌粉质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | M | 0.15 | 0.1 | 0 |
(1)M的数值为.________ 。
(2)请计算稀硫酸中硫酸所占的质量分数_______。
(3)含杂质的锌中锌的质量分数_______。
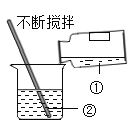
【题目】(一)小明在实验室观察完品红扩散实验后,想把变红的水做一个简单的处理后再排入下水道。请根据如图相关信息,回答下列问题:
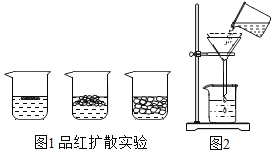
(1)图2过滤操作中必须用到的玻璃仪器分别是______、______、烧杯,请指出该操作过程中的其中两处错误______、______。
(2)小明同学将红色液体按过滤的正确操作完成后,发现过滤后的液体中仍有少量品红固体,则造成这种情况可能的原因是(填一种即可)______
(3)水是一种重要的资源,人类离不开水。在很长一段时期内,人类不了解水到底是由什么组成的。直到18世纪末,人类通过电解水实验才最终认识了水的组成。下列实验也能证明水是由氧元素和氢元素组成的是______(填序号)
A 氢气在氧气中燃烧 B 石蜡在空气中燃烧 C 水的蒸发 D 水的净化
(二)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:______。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行试验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比l:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验______形成对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是______。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和______;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证______。