题目内容
【题目】小强想探究实验室内一瓶久置的氢氧化钠溶液是否变质,用如图进行实验。
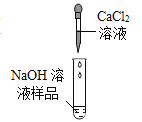
(1)小强观察到有白色沉淀生成,证明氢氧化钠样品确已变质。写出生成白色沉淀的化学方程式______。
(2)小强想检验这瓶已经变质的氢氧化钠溶液中是否还有未变质的氢氧化钠,请你在小强实验的基础上,设计实验进行验证______。
【答案】Na2CO3+CaCl2═CaCO3↓+2NaCl 继续滴加氯化钙溶液直至不产生白色沉淀,静置,滴加酚酞试液,溶液变红色,说明溶液中含有氢氧化钠,进一步说明氢氧化钠部分变质。(合理即可)
【解析】
(1)生成白色沉淀,是因为碳酸钠和氯化钙反应生成了碳酸钙白色沉淀和氯化钠,反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)由于碳酸钠溶液呈碱性,对氢氧化钠的检验有干扰,所以先用中性的氯化钙溶液将碳酸钠完全除去,再用酚酞试液检验是否存在氢氧化钠。实验方案:继续滴加氯化钙溶液直至不产生白色沉淀,静置,滴加酚酞试液,溶液变红色,说明溶液中含有氢氧化钠,进一步说明氢氧化钠部分变质。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
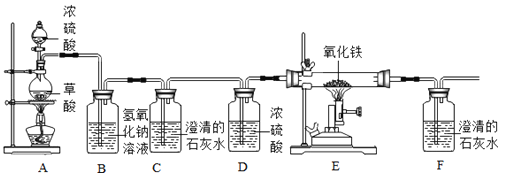
小学能力测试卷系列答案【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某兴趣小组的同学提出问题:氧化铁能否起到类似于二氧化锰的催化作用呢?于是他们进行了以下探究:
(猜想)
Ⅰ.氧化铁不是反应的催化剂、也不参与反应,质量和化学性质反应前后均不变;
Ⅱ.氧化铁参与反应产生氧气,反应前后质量不变,但化学性质发生了改变;
Ⅲ.氧化铁是反应的催化剂,反应前后_____。
(实验)用天平称0.2g氧化铁,用试管取5mL 5%的过氧化氢溶液,进行如图实验:
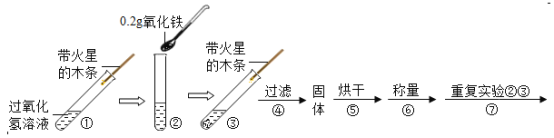
(注:氧化铁不溶于水,过滤可与水分离)
(1)填写如表:
步骤3现象 | 步骤6结果 | 步骤7现象 | 结论 |
带火星的木条复燃 | _____ | 过氧化氢溶液中,_____ | 猜想1、Ⅱ不成立, 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)步骤⑦重复实验②、③目的是_____。
【题目】某钙片的标签如图,且知此钙片成分中只有碳酸钙含有钙元素。
主要成分 | 碳酸钙(CaCO3)维生素 D; |
规格 | 每瓶 50 片,净重 40 克 |
含钙量 | 每片含钙0.75克 |
(1)根据标签中的含钙量,计算出每片钙片中碳酸钙的含量为多少克_____?(写过程)
(2)标签中的含钙量是否合理_____(填“是”或“否”)?
(3)其中维生素 D 有助于钙的吸收,已知维生素 D 是由碳、氢、氧三种元素组成,且碳、氢元素质量之比为 84:11,每个维生素 D 分子中只含有一个氧原子,请写出维生素 D 的化学式_____。
【题目】世界上每年因锈蚀而报废的金属设备和材料,高达产量的![]() ,某科学小组想对铁生锈进行探究。
,某科学小组想对铁生锈进行探究。
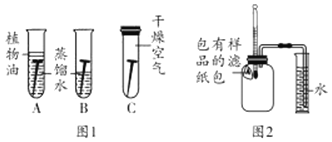
(实验探究)探究一:铁钉锈蚀条件:如图1所示,取3根粗细、长度均相同的光亮细铁钉,其中两根放入经煮沸迅速冷却的蒸馏水中,A试管上方加一层植物油;C试管中的铁钉放在干燥的空气中,加盖密封。一段时间后观察到:A、C中铁钉都没有生锈,而B中铁钉生锈。根据探究回答下列问题。
![]() 试管中加植物油的作用______。
试管中加植物油的作用______。
![]() 将蒸馏水煮沸的目的:______。
将蒸馏水煮沸的目的:______。
![]() 分析A、B、C试管中铁钉的锈蚀情况,由此可以得出铁制品锈蚀的条件______。
分析A、B、C试管中铁钉的锈蚀情况,由此可以得出铁制品锈蚀的条件______。
(实验探究)探究二:铁粉腐蚀的影响因素探究如图2所示,将包有样品潮湿的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进广口瓶![]() 容积为
容积为![]() 。当温度恢复至室温,且量筒内液面高度不变时读数
。当温度恢复至室温,且量筒内液面高度不变时读数![]() 此时瓶内氧气含量近似为零
此时瓶内氧气含量近似为零![]() ,记录起始和最终量筒的读数以及所需时间如表:
,记录起始和最终量筒的读数以及所需时间如表:
序号 | 铁粉 | 炭粉 | NaCl质量分数 | 量筒起始读数 | 量筒最终读数 | 所需时间 |
|
|
| 0 | 100 | 60 | 约190 |
|
|
| 5 | 100 | 60 | 约140 |
|
|
| 5 | 100 | 60 | 约160 |
|
|
| 10 | 100 | 60 | 约175 |
|
|
| 15 | 100 | 60 | 约185 |
![]() 实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是______
实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是______![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 过程。
过程。
![]() 实验开始一段时间后,量筒内的水会沿着导管进入集气瓶内,原因是______。
实验开始一段时间后,量筒内的水会沿着导管进入集气瓶内,原因是______。
![]() 从数据表上可以得出结论有______
从数据表上可以得出结论有______![]() 写任意两点
写任意两点![]() 。
。
![]() 影响金属锈蚀的因素除了上述的以外还有哪些其他因素______,请设计实验证明其中一种因素______。
影响金属锈蚀的因素除了上述的以外还有哪些其他因素______,请设计实验证明其中一种因素______。