题目内容
【题目】利用化学变化可以制备新物质.CO是一种无色、无臭的气体,密度比空气略小,难溶于水,易于血红蛋白结合,具有可燃性.请结合所学知识和CO的相关信息回答下列问题:
(1)下列两个反应都能生成CO,从实验室制备气体的思路分析,实验室制备CO选择反应②而不用①的理由是 (任选一个角度回答)
①炽热的焦炭和水蒸气反应:C+H2O![]() CO↑+H2↑
CO↑+H2↑
②草酸晶体和浓硫酸供热:H2C2O4![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)某同学设计下列装置制备、提纯CO,并用CO来还原氧化铜.请根据如图回答:
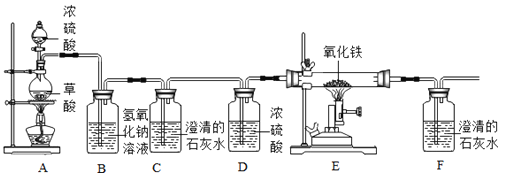
①写出一氧化碳还原氧化铁的化学反应方程式 。
②该同学的设计存在的一处明显缺陷是 .用改进后装置进行实验,在点燃E处酒精灯之前,必须进行的一项操作是 (从实验安全角度考虑)。
③装置B的作用是 ,B中发生反应的化学方程式为 。
④证明一氧化碳能还原氧化铁的实验现象是:装置E中固体颜色的变化为 ,C中 ,F中 。
【答案】(1)对比反应①、②的条件,反应①的温度更高
(2)①Fe2O3+3CO![]() 2Fe+3CO2 ②没有尾气处理装置 检验一氧化碳的纯度
2Fe+3CO2 ②没有尾气处理装置 检验一氧化碳的纯度
③除去CO中混有的CO2 2NaOH+CO2═Na2CO3+H2O
④红色变为黑色 澄清的石灰水没有变浑浊 澄清的石灰水变浑浊
【解析】
试题分析:(1)从实验室制备气体的思路分析,并且对比反应①和②,实验室制备CO选择反应②而不用①的理由是:对比反应①、②的条件,反应①的温度更高
(2)①一氧化碳还原氧化铁的化学反应方程式:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
②因为一氧化碳有毒,该同学的设计存在的一处明显缺陷是:没有尾气处理装置,直接将多余的一氧化碳排放到空气中,造成污染;一氧化碳还具有可燃性,当一氧化碳不纯时,点燃可能发生爆炸,故在点燃E处酒精灯之前,必须进行的一项操作是:检验一氧化碳的纯度
③装置B的作用是:除去CO中混有的CO2 ,防止对后面一氧化碳的生成物二氧化碳的判断造成干扰B中发生反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O
④一氧化碳能还原氧化铁生成单质铁和二氧化碳,故实验现象是:装置E中固体颜色的变化为红色变为黑色;C中澄清的石灰水没有变浑浊,证明装置B已经全部将二氧化碳除去了,F中澄清的石灰水变浑浊,证明反应生成了二氧化碳

【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
【提出问题】:常温下钠与氧气反应,产物有哪些?
【查阅资料】:钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
【作出猜想】:常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:
【实验探究一】:
实验操作 | 实验现象 | 实验结论 |
取少量钠的氧化物加入足量蒸馏水 | 猜想1正确 |
【继续探究】:钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】:
实验操作 | 实验现象 | 实验结论 |
1.取少量白色固体加入足量 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
2.过滤、取少量滤液加入 |
【实验反思】
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 。
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为 。
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 碱性氧化物(填“是”或“不是”)。