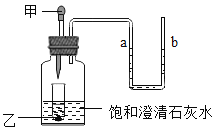
题目内容
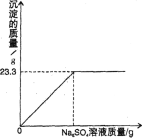
【题目】称取BaCl2和NaCl的固体混合物32.5g,加入82.8g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示。试回答下列问题:
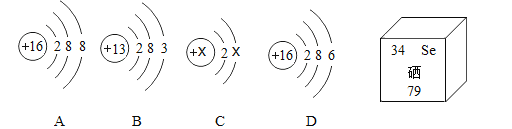
(1)Na2SO4和NaCl中均含有钠元素,钠元素位于元素周期表第____________周期。
(2)完全反应后生成BaSO4沉淀______________g。
(3)恰好完全反应时消耗Na2SO4溶液质量是_____________g。
(4)恰好完全反应时所得溶液中溶质的质量分数是____________?(精确到0.1%)(写出计算过程)
【答案】三 23.3g 142g 9.3%
【解析】
氯化钡和硫酸钠反应生成硫酸钡和氯化钠。
(1)钠原子核外有三个电子层,故钠元素位于元素周期表第三周期。
(2)由图中数据可知,完全反应后生成BaSO4沉淀的质量是23.3g。
(3)设恰好完全反应时消耗Na2SO4的质量是x
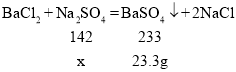
![]()
![]()
故恰好完全反应时消耗Na2SO4溶液的质量是![]()
(4)设反应的氯化钡的质量为y,生成的氯化钠的质量为z

![]()
![]()
恰好完全反应时,溶液中NaCl的质量为![]()
恰好完全反应时所得溶液中溶液溶质的质量分数为
![]()
答:恰好完全反应时所得溶液中溶质的质量分数是9.3%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
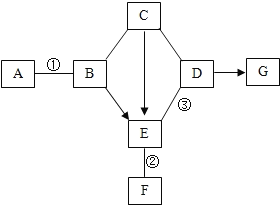
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
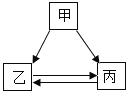
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D