题目内容
(5.5分)为验证二氧化碳和氢氧化钠溶液确实能发生化学反应,两个化学兴趣小组的同学进行了如下探究活动。
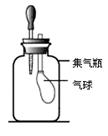
⑴第一小组:小莉同学设计了如下图所示实验装置,集气瓶中充满二氧化碳气体,滴管中吸入了氢氧化钠溶液,集气瓶中的气球通过导气管与外界空气相通。
同组的小华同学对此提出质疑,他将上述实验滴管中的氢氧化钠溶液换成 ,然后再重复完成实验,观察到现象是 。小华补充这一实验的原因是 。
⑵第二小组:小秦同学对实验装置做了如图改进。集气瓶中充满二氧化碳气体,气球通过导气管与外界空气相通,分液漏斗A中装有氢氧化钠溶液。分液漏斗B中装有另一种试剂。
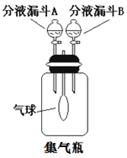
步骤一:打开分液漏斗A的活塞,使氢氧化钠溶液流入集气瓶中。
现象:气球逐渐变大。
步骤二:打开分液漏斗B的活塞,使 溶液流入集气瓶中。
现象: ,产生这一现象的化学反应方程式是 。
结论:二氧化碳和氢氧化钠溶液可以反应,该反应的化学方程式是 。
⑶对于现象不明显的化学反应,上述两组同学的实验是分别从反应物和生成物两个方面进行的探究验证,其所利用的原理是不同的。
①第一组是通过实验证明 验证化学反应发生了;
②第二组是通过实验证明 验证化学反应发生了。
⑴第一小组:小莉同学设计了如下图所示实验装置,集气瓶中充满二氧化碳气体,滴管中吸入了氢氧化钠溶液,集气瓶中的气球通过导气管与外界空气相通。

| 实验步骤 | 实验现象 | 实验结论 |
| 挤压滴管橡胶胶帽,使氢氧化钠溶液滴入集气瓶中。 | 气球逐渐变大 | 二氧化碳和氢氧化钠溶液确实发生了化学反应 |
⑵第二小组:小秦同学对实验装置做了如图改进。集气瓶中充满二氧化碳气体,气球通过导气管与外界空气相通,分液漏斗A中装有氢氧化钠溶液。分液漏斗B中装有另一种试剂。

步骤一:打开分液漏斗A的活塞,使氢氧化钠溶液流入集气瓶中。
现象:气球逐渐变大。
步骤二:打开分液漏斗B的活塞,使 溶液流入集气瓶中。
现象: ,产生这一现象的化学反应方程式是 。
结论:二氧化碳和氢氧化钠溶液可以反应,该反应的化学方程式是 。
⑶对于现象不明显的化学反应,上述两组同学的实验是分别从反应物和生成物两个方面进行的探究验证,其所利用的原理是不同的。
①第一组是通过实验证明 验证化学反应发生了;
②第二组是通过实验证明 验证化学反应发生了。
(1)等体积的水 气球也变大但比小莉做的实验中的气球小
水也能吸收二氧化碳,也会使气球变大,需做对比实验确认是二氧化碳与氢氧化钠溶液的反应。
⑵过量稀盐酸 有大量气泡产生,气球变小 Na2CO3+2HCl="==2NaCl" + CO2 ↑+H2O
CO2+2NaOH===Na2CO3+H2O
⑶①有物质被消耗 ②有新物质生成
水也能吸收二氧化碳,也会使气球变大,需做对比实验确认是二氧化碳与氢氧化钠溶液的反应。
⑵过量稀盐酸 有大量气泡产生,气球变小 Na2CO3+2HCl="==2NaCl" + CO2 ↑+H2O
CO2+2NaOH===Na2CO3+H2O
⑶①有物质被消耗 ②有新物质生成
试题分析:(1)同组的小华同学对此提出质疑,原因是有可能是二氧化碳溶解在了氢氧化钠溶液中的水里面去了,同样会使集气瓶内的压强减少,气球变大,所以为了排除这种情况,就应该做对比实验,所以将上述实验滴管中的氢氧化钠溶液换成等体积的水,观察到现象是:气球也变大但比小莉做的实验中的气球小,这样才能说明二氧化碳和氢氧化钠溶液确实发生了化学反应
(2)要判断二氧化碳和氢氧化钠溶液是否发生了化学反应,还可以通过检验两者反应后的生成物来判断,所以步骤二:打开分液漏斗B的活塞,使过量稀盐酸溶液流入集气瓶中,过量稀盐酸就会与反应后生成的碳酸钠反应,生成二氧化碳气体,所以现象是:有大量气泡产生,气球变小,产生这一现象的化学反应方程式:Na2CO3+2HCl="2NaCl" + CO2 ↑+H2O,二氧化碳和氢氧化钠溶液可以反应,该反应的化学方程式:CO2+2NaOH=Na2CO3+H2O
(3)①第一组是通过实验证明有物质被消耗验证化学反应发生了;第二组是通过实验证明有新物质生成验证化学反应发生了

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目