题目内容
FeCl3溶液腐蚀铜、铁的反应分别为:Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2。
从腐蚀过镀铜器件的废液中回收铜,并重新制得FeCl3的流程如下:

下列说法不正确的是
从腐蚀过镀铜器件的废液中回收铜,并重新制得FeCl3的流程如下:

下列说法不正确的是
| A.步骤②中发生化合反应与置换反应 |
| B.“滤液1”中一定含FeCl2,可能含CuCl2 |
| C.步骤④反应为:2M+2FeCl2+ H2O2=2FeCl3+2H2O,M是HCl |
| D.若滤渣也为m1g,则废液中FeCl3与CuCl2的质量比为65∶54 |
BD
试题分析:A. 步骤②中发生的反应有Fe+2FeCl3=3FeCl2(化合反应)、Fe+CuCl2=FeCl2+Cu(置换反应);B.因为铁过量,CuCl2完全反应,故不含CuCl2;C.H2O2具有氧化性,且化学方程式符合质量守恒定律,故说法正确;D.滤渣与原铁粉质量相等,即生成的铜等于两个反应溶解的铁,设生成铜的质量为64,则Fe+CuCl2=FeCl2+Cu中反应的铁为56,反应的CuCl2为135,Fe+2FeCl3=3FeCl2中反应的铁为8,FeCl3为
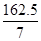 ,故废液中FeCl3与CuCl2的质量比为
,故废液中FeCl3与CuCl2的质量比为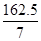 :135=65:54×7,故D错误.
:135=65:54×7,故D错误.
练习册系列答案
相关题目
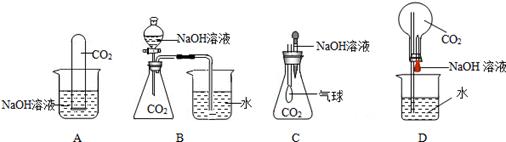


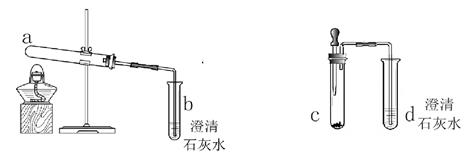
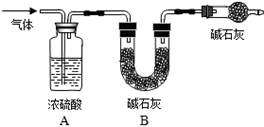
 Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。
Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。