题目内容
【题目】钢铁是目前世界上使用最多的金属材料。我国早在春秋战国时期就开始炼铁、应用金属铁。
炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料放入高炉,在高温条件下,炼铁,反应过程如下图所示。则回答:

(1)原料中焦炭在第①②步中都要用到,则焦炭的作用是______________。在冶炼反应过程中应先__________ (填“加热”或“通入CO”),其目的___________。
(2)当反应进行一段时间后,第③步中出现的现象为___________________,该反应化学方程式为______________。冶炼铁时除CO外,还可用_______等物质来还原赤铁矿中的氧化铁 。
(3)中国钢铁公司为了测定朝鲜茂山铁矿的优质赤铁矿中氧化铁的质量分数。公司实验室取该赤铁矿样品10g与足量的一氧化碳充分反应,测得反应后固体物质的质量为7.6g(假设赤铁矿中的杂质不参加反应)。则赤铁矿样品中氧化铁的质量分数为_____。
【答案】作燃料提供高温并生成还原剂CO 通入CO 排出空气,防止加热时发生爆炸 红色固体变为黑色 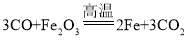 C或H2 80%
C或H2 80%
【解析】
由流程图可知,第①步焦炭与过量氧气反应生成二氧化碳,第②步二氧化碳与焦炭在高温下反应生成一氧化碳,第③步一氧化碳与三氧化二铁高温条件下反应生成铁和二氧化碳,则有:
(1)原料中焦炭在第①②步中都要用到,则焦炭的作用是作燃料提供高温并生成还原剂CO。在冶炼反应过程中应先通入CO,其目的排出空气,防止加热时发生爆炸。
(2)当反应进行一段时间后,第③步一氧化碳与三氧化二铁高温条件下反应生成铁和二氧化碳,出现的现象为红色固体变为黑色,该反应化学方程式为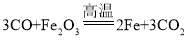 。单质碳、氢气也具有还原性,冶炼铁时除CO外,还可用C、H2等物质来还原赤铁矿中的氧化铁。
。单质碳、氢气也具有还原性,冶炼铁时除CO外,还可用C、H2等物质来还原赤铁矿中的氧化铁。
(3)由题意赤铁矿样品10g与足量的一氧化碳充分反应,测得反应后固体物质的质量为7.6g,反应的化学方程式为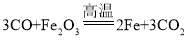 ,根据方程式可知固体质量的减少量即为氧化铁中氧元素的含量,则氧化铁中氧元素的质量为10g-7.6g=2.4g,设氧化铁的质量为x,则有:
,根据方程式可知固体质量的减少量即为氧化铁中氧元素的含量,则氧化铁中氧元素的质量为10g-7.6g=2.4g,设氧化铁的质量为x,则有:
![]()
解得x=8g
赤铁矿样品中氧化铁的质量分数为![]()
答:赤铁矿样品中氧化铁的质量分数为80%。

 阅读快车系列答案
阅读快车系列答案