题目内容
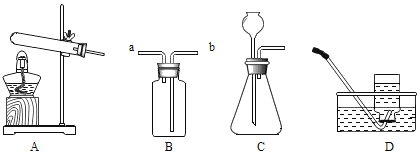
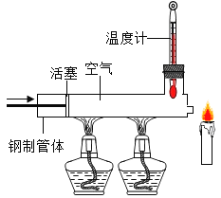
【题目】实验室中,利用下列装置可以制取某些气体,请回答下列问题。
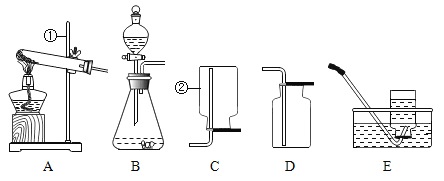
(1)写出带标号的仪器的名称:①__________ ;②__________。
(2)向气体发生装置内加入药品前,应该进行的操作是________________。
(3)实验室若用高锰酸钾制取氧气,选择的发生装置是__________;化学反应文字表达式为 _________________ ;用氯酸钾制氧气的化学反应文字表达式为 ________________,该反应属于_____________反应。
(4)实验室用高锰酸钾制取氧气时,在试管口塞一团棉花的目的是 _________________。实验完毕,停止加热时应该先_________________。
(5)乙炔是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔。你认为制取较纯净的乙炔的发生装置_____,收集装置是________。
【答案】铁架台 集气瓶 检查装置的气密性 A 高锰酸钾 ![]() 锰酸钾 + 二氧化锰 + 氧气 氯酸钾
锰酸钾 + 二氧化锰 + 氧气 氯酸钾![]() 氯化钾+氧气 分解反应 防止高锰酸钾粉末进入导气管 先将导气管从水槽中取出 B E
氯化钾+氧气 分解反应 防止高锰酸钾粉末进入导气管 先将导气管从水槽中取出 B E
【解析】
(1)铁架台;集气瓶
(2)实验开始前一定要检查装置气密性;
(3)实验室高锰酸钾制氧气选择固体加热装置A;高锰酸钾制氧气反应原理:高锰酸钾 ![]() 锰酸钾 + 二氧化锰 + 氧气;氯酸钾制氧气反应原理:氯酸钾
锰酸钾 + 二氧化锰 + 氧气;氯酸钾制氧气反应原理:氯酸钾![]() 氯化钾+氧气;该反应符合“一变多”,属于分解反应;
氯化钾+氧气;该反应符合“一变多”,属于分解反应;
(4)试管口放置棉花的目的是为了防止加热时高锰酸钾粉末进入玻璃导管,影响实验;实验完毕后,先将导管撤离水槽,再熄灭酒精灯停止加热;
(5)制取乙炔应选择固、液发生装置B;乙炔是一种无色、无味、密度比空气略小,不溶于水的气体,用排水法收集可以得到更加纯净的气体。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】利用物质沸点不同可以实现混合物的分离,根据下表数据判断。
物质 |
|
|
|
|
沸点/℃ | -252.8 | -195.8 | -183.0 | -33.35 |
(1)工业上制取氧气,控制温度在_____℃<T<_____℃时,可以将液态空气中的氮气与氧气分离开。
(2)要将工业合成氨的产物氨气(![]() )从它的反应物氮气和氢气的混合物中分离开来,最适宜的温度应该控制在_____℃<T<_____℃。
)从它的反应物氮气和氢气的混合物中分离开来,最适宜的温度应该控制在_____℃<T<_____℃。
(3)工业上制备氧气利用分离液态空气的方法,属于_____(填“物理”或“化学”)变化。
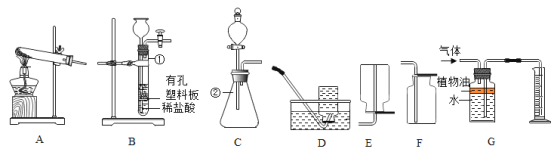
【题目】某兴趣小组同学对实验室制取氧气的条件进行如下探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
①3.0gKClO3与1.0gMnO2均匀混合加热
②将Xg KClO3与1.0g氧化铜均匀混合加热,在相同温度下,比较两组实验产生O2的快慢。
①中反应的符号表达式是___________;②中X的值为________。
(2)乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 | 双氧水的浓度 | 二氧化锰的质量 | 相同时间内产生氧气的体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2的装置是_________(填序号)。
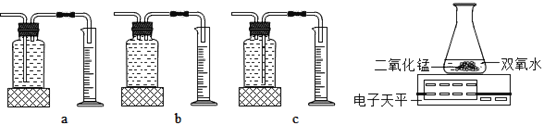
实验结论:在相同条件下_________________,双氧水分解得快。丙用装置电子天平进行实验,通过比较_____________________也能达到实验目的。