题目内容
【题目】某兴趣小组的同学对糖衣片中硫酸亚铁晶体(FeSO4xH2O)的组成进行了探究。
【查阅资料】
(1)硫酸亚铁晶体加热先失去结晶水,高温继续分解产生一种金属氧化物和两种非金属氧化物。
(2)能使高锰酸钾溶液褪色的气体有二氧化硫、乙烯(C2H4)等。
【进行实验】
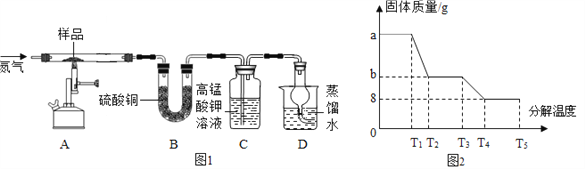
该兴趣小组同学称取ag硫酸亚铁晶体(FeSO4xH2O)样品按图1装置高温加热,使其完全分解,并对所得产物进行分析,利用SDTQ600热分析仪对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示关系图。
【数据分析】(假设反应均完全)
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有(填化学式,下同)______;装置C中高锰酸钾溶液褪色,说明产物中还有________。
(2)T4℃时,硫酸亚铁晶体完全分解后装置A中固体呈红色,加入足量稀盐酸,固体全部溶解,得到黄色溶液,写出发生反应的化学方程式_______________。
(3)兴趣小组的同学从理论上分析硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式__________________。
(4)请根据上述实验及图2中有关数据,计算出FeSO4xH2O中的x为________,绿矾样品的质量a为_________。
【交流讨论】
(1)实验中选择通入氮气是利用氮气的化学性质__________(填“活泼”或“不活泼”)。
(2)反应完全后仍要持续通入氮气,否则测出的x值会__________(填“偏大”、“偏小”或“不变”)。
【答案】 H2O SO2 Fe2O3+6HCl=2FeCl3+3H2O 2FeSO4![]() Fe2O3+SO2↑+SO3↑ 7 27.8 不活泼 偏小
Fe2O3+SO2↑+SO3↑ 7 27.8 不活泼 偏小
【解析】(1). 无水硫酸铜粉末能和水反应生成蓝色硫酸铜晶体,图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有H2O (2). 能使高锰酸钾溶液褪色的气体有二氧化硫、乙烯(C2H4)等据质量守恒定律可知反应前后元素种类不变,装置C中高锰酸钾溶液褪色,说明产物中还有还原性物质SO2 (3). T4℃时,硫酸亚铁晶体完全分解后装置A中固体呈红色,加入足量稀盐酸,固体全部溶解,得到黄色溶液,说明固体为氧化铁,氧化铁和盐酸反应生成氯化铁和水,反应化学方程式Fe2O3+6HCl=2FeCl3+3H2O (4). 由题中信息可知,硫酸亚铁在高温下分解生成氧化铁、二氧化硫、水,反应方程式为:2FeSO4高温Fe2O3+SO2↑+SO3↑ (5). 图1装置B中质量增加12.6g,说明生成水的质量为12.6g;最终固体为氧化铁,所以氧化铁的质量为8g;其中铁元素的质量为 8g ×![]() =5.6g;铁和水的质量关系可得:56:18x=5.6g :12.6g ;x= 7;(6). FeSO4xH2O的化学式为:FeSO47H2O,FeSO47H2O 的质量为x,则x×
=5.6g;铁和水的质量关系可得:56:18x=5.6g :12.6g ;x= 7;(6). FeSO4xH2O的化学式为:FeSO47H2O,FeSO47H2O 的质量为x,则x×![]() =5.6g ,x=27.8 g (7). 实验中选择通入氮气是利用氮气的化学性质不活泼 ,防止铁元素和空气中的氧结合; (8). 反应完全后仍要持续通入氮气,否则测出的x值会偏小。
=5.6g ,x=27.8 g (7). 实验中选择通入氮气是利用氮气的化学性质不活泼 ,防止铁元素和空气中的氧结合; (8). 反应完全后仍要持续通入氮气,否则测出的x值会偏小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案