题目内容
(8分)
体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl = MgCl2+H2O
MgCO3+2HCl = MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
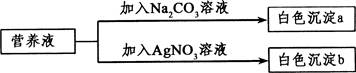
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是____________。则证明“镁粉”中一定含有MgCO3。
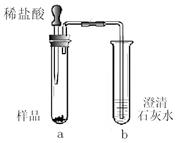
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成__________。小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ。用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5 g三种固体粉末,每次取样方法如下图所示:
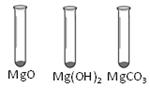
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ。取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119 mL和140 mL。由此可知“镁粉”中含有MgCO3的质量分数为___________,“镁粉”中除MgCO3外的另一种物质为_____________。
体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl = MgCl2+H2O
MgCO3+2HCl = MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是____________。则证明“镁粉”中一定含有MgCO3。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成__________。小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ。用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5 g三种固体粉末,每次取样方法如下图所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| | MgO | Mg(OH)2 | MgCO3 |
| 消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Ⅱ。取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119 mL和140 mL。由此可知“镁粉”中含有MgCO3的质量分数为___________,“镁粉”中除MgCO3外的另一种物质为_____________。
(1)①澄清石灰水变浑浊 ②氢氧化钠浓溶液 不含Mg
(2)【实验过程】 Mg(OH)2 + 2HCl ="=" MgCl2 + 2H2O
【实验分析及结论】 0.5 g “镁粉”消耗的盐酸体积与0.5 g MgCO3消耗的盐酸体积不相等
【实验反思】 MgCO3 85% Mg(OH)2
(2)【实验过程】 Mg(OH)2 + 2HCl ="=" MgCl2 + 2H2O
【实验分析及结论】 0.5 g “镁粉”消耗的盐酸体积与0.5 g MgCO3消耗的盐酸体积不相等
【实验反思】 MgCO3 85% Mg(OH)2
试题分析:(1)①碳酸盐的性质,能与酸反应产生二氧化碳,所以取少量样品,加入稀盐酸,观察到a试管中有气泡产生,b试管中产生的现象是:澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3
②由于反应过程中产生二氧化碳,而澄清石灰水的溶质氢氧化钙是微溶于水,吸收二氧化碳的效果不好,所以要使该实验能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液,这样就能充分吸收二氧化碳,小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,说明无氢气产生,证明“镁粉”中不含Mg
(2)【实验过程】Mg(OH)2与盐酸发生中和反应的化学方程式为:Mg(OH)2 + 2HCl ="=" MgCl2 + 2H2O
Ⅱ、取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL,根据数据分析,“镁粉”不只含有MgCO3,理由是:0.5 g “镁粉”消耗的盐酸体积与0.5 g MgCO3消耗的盐酸体积不相等
【实验反思】为确定“镁粉”的具体成分,做对比实验,分别取0.5 g“镁粉”和0.5 g纯净的MgCO3,根据加入足量稀盐酸,测定生成的气体体积分别为119 mL和140 mL,可知“镁粉”中含有MgCO3的质量分数=119mL/140mL×100%=85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目