题目内容
(6分)粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如下图所示:
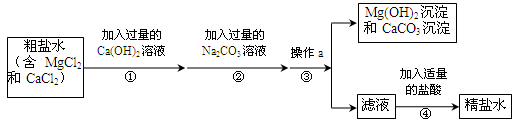
(1)Ca(OH)2溶液的pH (填“>”、“=”或“<”)7。步骤①反应的化学方程式为 。
(2)步骤③操作a的名称是 。步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和 。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有 。

(1)Ca(OH)2溶液的pH (填“>”、“=”或“<”)7。步骤①反应的化学方程式为 。
(2)步骤③操作a的名称是 。步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和 。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有 。
(1)> MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
(2)过滤 Na OH
(3)CaCl2
(2)过滤 Na OH
(3)CaCl2
试题分析:(1)Ca(OH)2溶液呈碱性,pH大于7;Ca(OH)2溶液只能与粗盐水中的MgCl2反应,化学反应方程式是:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓;
(2)经过①②后,生成沉淀,要进行过滤实验除去沉淀,所以步骤③操作a的名称是过滤;步骤①中过量的氢氧化钙和生成的氯化钙与步骤②中过量的碳酸钠反应碳酸钙沉淀、氯化钠、氢氧化钠.化学方程式是:CaCl2+Na2CO3═CaCO3↓+2NaCl;Ca(OH)2+Na2CO3═CaCO3↓+CaOH,所以步骤④加入适量的盐酸可以除去滤液中步骤②加入的多余的Na2CO3和生成的NaOH;
(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2.如果步骤①和步骤②的顺序颠倒,步骤②先反应溶液中就有过量的碳酸钠,然后完成步骤①,这时过量的氢氧化钙把上步中多余的碳酸钠除去,同时生成氢氧化钠,另外氢氧化钙与氯化镁反应还生成氯化钙,最后步骤④中加入适量的盐酸,反应掉生成的氢氧化钠,但不与生成的氯化钙反应,所以最后所得的精盐水中还含有CaCl2。

练习册系列答案
相关题目