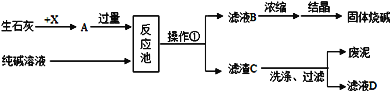
题目内容
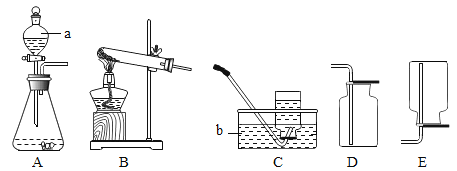
【题目】如图是测定某赤铁矿粉中Fe2O3质量分数的实验装置:
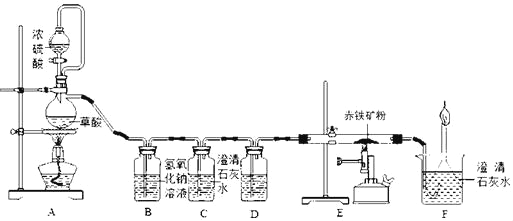
(1)A装置的作用是制取一氧化碳,反应的化学方程式为H2C2O4 =CO2↑+CO↑+H2O.根据反应装置判断,化学方程式中还缺少的条件是_____。
(2)C装置的作用是_____,D装置中药品的名称是_____,E装置中发生反应的化学方程式为_____,F处将尾气燃烧掉的目的是_____。
(3)实验过程中应该先点燃A处还是E处的加热装置?_____。
(4)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为_____。
玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
71.8g | 81.8g | 79.4克 |
(5)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?说出你的观点和理由是_____。
【答案】加热 检验二氧化碳是否被氢氧化钠溶液完全吸收 浓硫酸 Fe2O3+3CO![]() 2Fe+3CO2 除去一氧化碳,防止污染环境 A 80% 不同意,这是因为澄清石灰水中氢氧化钙很少,不一定把生成二氧化碳完全吸收,同时空气中的二氧化碳也能被澄清石灰水吸收 。
2Fe+3CO2 除去一氧化碳,防止污染环境 A 80% 不同意,这是因为澄清石灰水中氢氧化钙很少,不一定把生成二氧化碳完全吸收,同时空气中的二氧化碳也能被澄清石灰水吸收 。
【解析】
(1)根据实验装置可知,化学方程式中还缺少的条件是加热;
(2)C装置的作用是检验二氧化碳是否被氢氧化钠溶液完全吸收,若澄清石灰水不变浑浊,则二氧化碳已完全吸收;从C装置中导出的气体中存在水蒸气,浓硫酸具有吸水性。D装置中药品的名称是浓硫酸,E装置中氧化铁和一氧化碳反应生成铁和二氧化碳,发生反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,F处将尾气燃烧掉的目的是除去一氧化碳,防止污染环境。
2Fe+3CO2,F处将尾气燃烧掉的目的是除去一氧化碳,防止污染环境。
(3)实验过程中应该先点燃A处的加热装置,这是因为如果先点燃E处,则一氧化碳和空气混合后加热可能发生爆炸;
(4)样品质量为:81.8g﹣71.8g=10g,
氧化铁中氧元素质量为:81.8g﹣79.4g=2.4g,氧化铁质量=![]() ;赤铁矿中氧化铁的质量分数=
;赤铁矿中氧化铁的质量分数=![]() ;
;
(5)不同意,这是因为澄清石灰水中氢氧化钙很少,不一定把生成二氧化碳完全吸收,同时空气中的二氧化碳也能被澄清石灰水吸收。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案